常考过渡金属元素
时间:2022-05-02 09:53 来源:未知 作者:化学自习室 点击: 次 所属专题: 过渡元素
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、铬(Cr)
1.铬比较活泼,铬在冷、浓硝酸中“钝化”。铬能溶于稀盐酸、稀硫酸,开始生成蓝色的Cr2+溶液,而后被空气中的氧气氧化成绿色的Cr3+溶液 ,Cr3+比Cr2+稳定:
Cr+2HCl===CrCl2+H2↑
4CrCl2+4HCl+O2===4CrCl3+2H2O
向Cr3+溶液中逐滴加入2mol/L NaOH,先生成灰绿色沉淀,后沉淀溶解,形成亮绿色溶液:
Cr3++3OH-===Cr(OH)3↓
Cr(OH)3+OH-===Cr(OH)4-
2.+6价铬有CrO42-和Cr2O72-,在溶液中两者可以相互转化:2CrO42-(黄)+2H+ Cr2O72-(橙)+H2O
Cr2O72-(橙)+H2O
3.常利用CrO42-与Ag+、Pb2+金属离子反应生成难溶性铬酸盐Ag2CrO4(砖红色)、PbCrO4(黄色),来进行沉淀滴定。
4.K2Cr2O7具有强氧化性,通常用硫酸酸化,增强氧化性。在冷溶液中,K2Cr2O7可以氧化H2S、H2SO3、HI:
Cr2O72-+3H2S+8H+===2Cr3++3S↓+7H2O
Cr2O72-+3H2SO3+2H+===2Cr3++3SO42-+4H2O
Cr2O72-+6I-+14H+===2Cr3++3I2+7H2O
加热时,K2Cr2O7和浓盐酸反应,产生氯气:
K2Cr2O7+14HCl(浓) 2KCl+2CrCl3+3Cl2↑+7H2O
2KCl+2CrCl3+3Cl2↑+7H2O
在分析化学中,常用K2Cr2O7来测定铁的含量。
2Mn2++5S2O82-+8H2O 2MnO4-+10SO42-+16H+
2MnO4-+10SO42-+16H+
2Mn2++5BiO3-+14H+ 2MnO4-+5Bi3++7H2O
2MnO4-+5Bi3++7H2O
4.在熔融碱中MnO2被空气氧化生成K2MnO4
二、锰(Mn)
1.锰能溶于盐酸或硫酸生成Mn2+和H2:
Mn+2H+===Mn2++H2↑
2.在碱性环境中,Mn2+极易被氧化成Mn4+的化合物:
2Mn(OH)2+O2===2MnO(OH)2
3.Mn2+很稳定。在酸性环境中,只有强氧化剂(NH4)2S2O8、NaBiO3等才可将其氧化成MnO4-:
4.2MnO2+O2+4KOH 2K2MnO4(深绿色)+2H2O
2K2MnO4(深绿色)+2H2O
5.在酸性、中性及弱碱性环境中,K2MnO4发生配位数的配位离子(如[Fe(CN)6]3-);而Ni2+与常见的配体(如NH3)会形成四配位数的配位离子(如[Ni(NH3)4]2+)。
(一)铁(Fe)
1.铁主要有+2、+3、+6三种价态。在酸性溶液中,FeO42-是一种很强的氧化剂,一般的氧化剂很难把Fe3+氧化成FeO42-。但在强碱性介质中,+3价铁却能被一些氧化剂(如NaClO)氧化成紫红色的高铁酸盐溶液:
2Fe(OH)3+3ClO-+4OH-===2FeO42-+3Cl-+5H2O
也可将Fe2O3、KNO3和KOH混合加热共熔,生成紫红色高铁酸钾:
Fe2O3+3KNO3+4KOH 2K2FeO4+3KNO2+2H2O
2K2FeO4+3KNO2+2H2O
2.将FeO42-溶液进行酸化时,迅速分解成Fe3+:
4FeO42-+20H+===4Fe3++3O2↑+10H2O
3.铁氰配合物:
Fe2+和Fe3+都能与CN-形成稳定的铁氰配合物。Fe2+先与KCN溶液生成Fe(CN)2沉淀,KCN过量则沉淀溶解:
FeSO4+2KCN===Fe(CN)2↓+K2SO4
Fe(CN)2+4KCN===K4[Fe(CN)6](亚铁氰化钾)
Fe3+与K4[Fe(CN)6]反应生成蓝色沉淀:
4Fe3++3[Fe(CN)6]4-===Fe4[Fe(CN)6]3↓
K3[Fe(CN)6](铁氰化钾)与Fe2+反应生成蓝色沉淀:
3Fe2++2[Fe(CN)6]3-===Fe3[Fe(CN)6]2↓
(二)钴(Co)和镍(Ni)
1.钴、镍的氧化物和氢氧化物中的价态一般为+2、+3,+3价的化合物具有较强的氧化性:
2Co(OH)3+6HCl===2CoCl2+Cl2↑+6H2O
2.钴与氯气反应生成二氯化钴。二氯化钴含结晶水数目不同而呈现不同颜色:
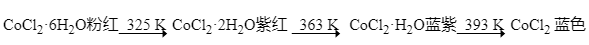
蓝色无水二氯化钴在潮湿的空气中会逐渐变成粉红色,这一性质可用在作干燥剂的硅胶中。
四、铜(Cu)
1.Cu有+1、+2价。氧化亚铜是红色,氧化铜是黑色。
2.Cu2+与常见配位体(NH3、乙二胺等)会形成四配位数的配位离子:[Cu(NH3)4]2+(深蓝色)、
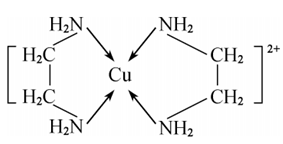 。
。
3.2Cu2++4I-===2CuI↓+I2
4.Cu+CuCl2===2CuCl
5.碘量法测定
Cu2+:2Cu2+~2S2O32-~2I-~I2

- 全部评论(0)
