有机化学反应拓展:基本反应及机理
时间:2022-10-13 19:17 来源:未知 作者:化学自习室 点击: 次 所属专题: 有机反应机理
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
有机反应主要分为【1】自由基反应;【2】离子型反应;【3】协同反应,这三种基本反应类型。这每大块如果要讲得清清楚楚的话,文章篇幅那就会飚到万字论文级的了,因此笔者只在此做简要介绍。可以先看看下图的Mind Map,笔者下文的思路就按照这个来。
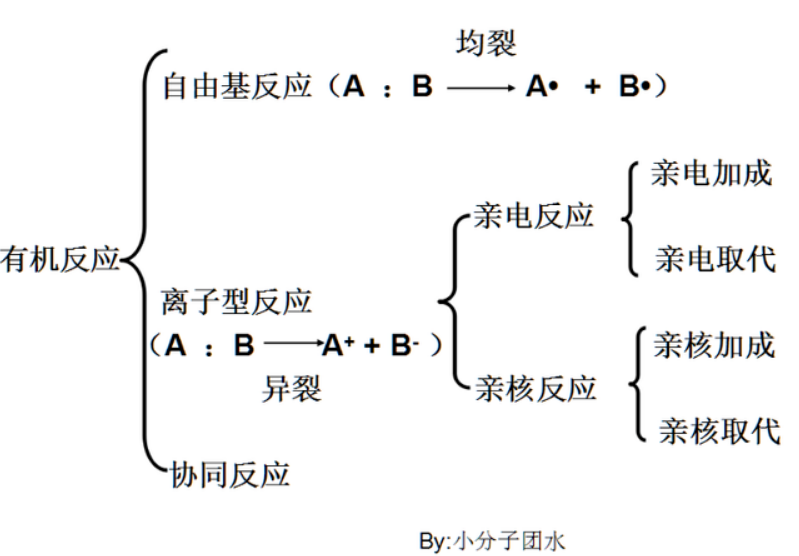
初中我们判断一个反应的原则是有没有新物质生成,高中更进一步,有没有旧化学键的断裂和新化学键的生成。有机物一般是C、H、N、O等原子通过共价键连接的。共价键如何断裂和有机反应类型息息相关。
【自由基反应】
上文提到的自由基反应和均裂反应有关,均裂反应是指:共价键断裂时原成键的一对电子平均分给2个原子或基团,共用电子对各取一半形成了自由基。比如甲烷和氯气在光照下的反应是一种自由基取代反应。
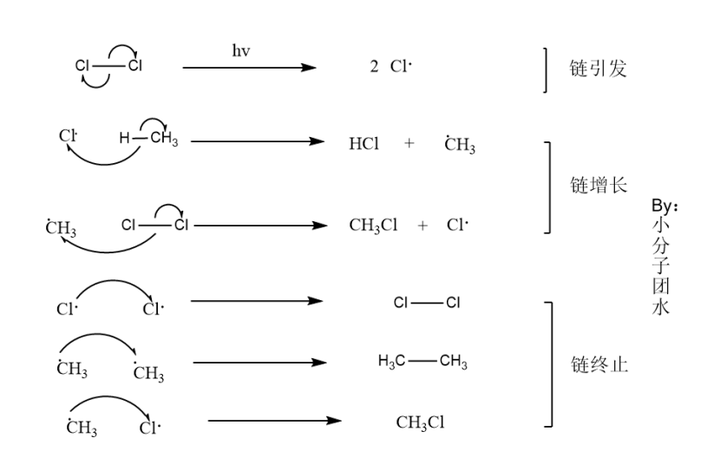
【自由基取代反应】
这里不妨用甲烷和氯气的反应举例,谈谈自由基取代反应机理,自由基取代反应是一种链式反应分为链引发、链增长、链终止三个阶段。在光照条件下,一当量的氯气分子发生均裂反应,形成了2个氯自由基,此过程称为链引发阶段;氯自由基电负性大,反应活性高,结合甲烷的氢原子生成氯化氢和碳碳自由基,碳自由基继续和氯分子反应,继续生成高活性的氯自由基和产物氯甲烷,此过程得到了氯取代产物,同时也生成了能够继续反应的氯自由基,这过程为链增长阶段。最后氯自由基结合成氯分子不在为非作歹,其他自由基也嫁鸡随鸡嫁狗随狗变成了稳定分子,没有新的自由基产生,达到链终止阶段。
【自由基加成反应】
溴化氢的与不对称烯烃加成反应是一类亲电加成反应(本文后面会提及这个类反应)一般是符合马氏规则的(Markovnikov principle),但是自由基加成反应得到的是反马氏产物。笔者以过氧化合物催化氢溴酸与不对称烯烃加成为例,讨论其反应机理。
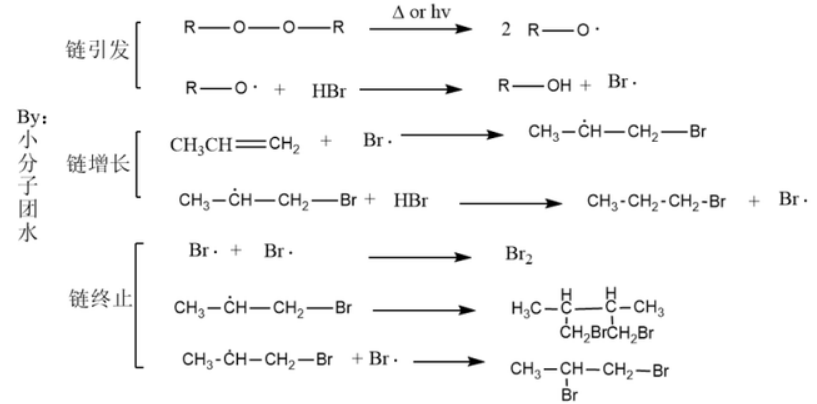
与自由基取代反应类似,自由基加成反应也经历了链引发、链增长、链终止三个阶段,过氧化物在此反应过程中起到了链引发剂的作用。烷氧基结合溴化氢的氢原子,得到高活性的溴自由基,溴自由基“横冲直撞”进攻不对称烯烃得到了碳自由基,值得注意的是此时有生成伯碳自由基和叔碳自由基2种方式,由于叔碳自由基比伯碳自由基更稳定,向叔碳自由基的转化的倾向更大。最后溴自由基相遇形成稳定溴分子,其他自由基也各回各家,各找各妈形成稳定的分子。
值得注意的是,自由基反应一般释放能量,而且反应速度很快。
【协同反应】
协同反应是指反应过程中只有键变化的过渡态,成键和断键同时发生,没有活性中间体生成。协同反应也称为分子型反应,其特点是一步反应,有一个环状过渡态。协同反应从不拈花惹草,条件专一,受光和热影响,其反应速率很少受到溶剂极性、酸碱催化剂、自由基引发剂抑制剂影响。
这里不妨以Name Reaction中的Diels-Alder反应谈谈其反应机理。Diels-Alder反应是指含有一个活泼的双键或三键的化合物(称为亲双烯体)与共轭二烯烃(双烯体)发生1,4加成,生成稳定的环状化合物。

反应时,双烯体和亲双烯体彼此靠近,相互作用,形成一个环状的过渡态,然后逐渐转化为分子。相互作用时,一般是双烯体的HOMO的电子流入亲双烯体的LUMO形成过渡态,稳定后即为产物。
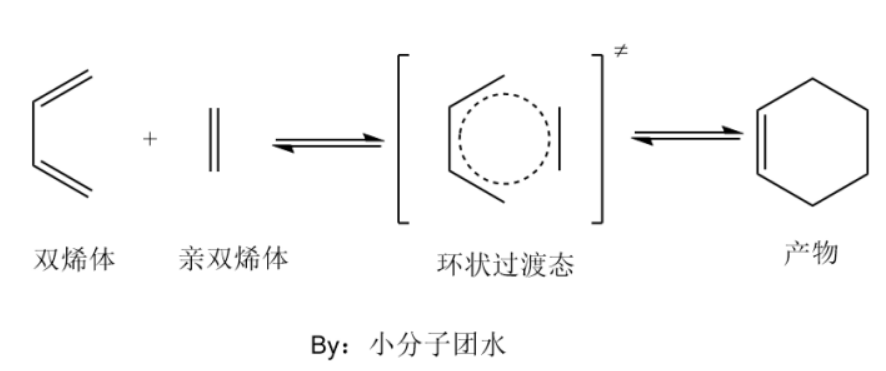
Diels-Alder反应是一类高效的成环反应,在有机合成里面用的颇多。
【离子型反应】
离子型反应是共价键异裂导致的,键断裂时原成键的一对电子为某一原子或基团所占有。由于一般离子的稳定性比自由基高得多,所以反应类型也很多花样。从上文mind map中可以看到离子反应是占大块的,主要占有机反应的90%。离子反应分为亲电反应和亲核反应,这两种反应可以都细分为取代反应和加成反应。
首先说说亲电反应和亲核反应的区别吧,这两大反应是根据进攻试剂的种类而分的。进攻试剂分为亲电试剂和亲核试剂。
亲电试剂一般都是带正电荷的试剂或具有空的p 轨道或者d轨道,能够接受电子对的中性分子,亲电试剂大多数是带有正电荷的,容易结合底物的负电部分,发生亲电反应。常见的亲电子试剂有阳离子(如H+ 和 NO2+)、 极性分子(如卤化氢、 卤代烃、 酰卤和羰基化合物)、可极化中电性分子(如Cl2 和 Br2)、 氧化剂以及某些Lewis酸(如 BH3 和 DIBAL)
亲核试剂一般含有孤对的电子,通常带负电荷或者是Lewis碱,亲核试剂的负电部分能够进攻底物的正电部分而发生亲核反应。常见的亲核试剂HO-、RO-、CN-、X-、 H2O、NH3和ROH等。
【亲电取代反应】
亲电取代反应,是亲电试剂进攻化合物负电部分,取代其它基团的化学反应。亲电取代反应的底物主要是芳香环(一般是苯环或者有芳香性的杂环化合物),具体反应机理为亲电试剂的正电性部分先和芳香形成π络合物,然后再转化为σ络合物,由催化剂或路易斯碱拔去质子氢回到芳环结构。苯环上常见的亲电取代反应有卤化反应、硝化反应、磺化反应、付克烷基化反应、付克酰基化反应和氯甲基化反应。下图是亲电取代反应的机理。
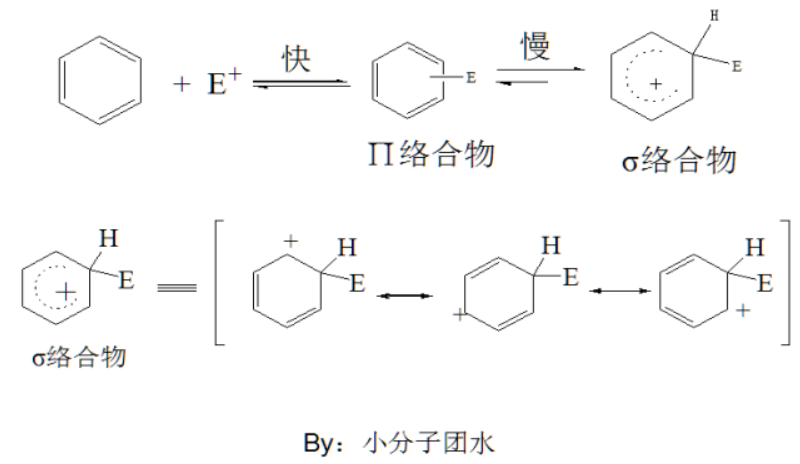
这里我们以苯的溴化反应为实例,分析其反应机理。在催化剂三溴化铁的作用下,溴分子极化,其中溴正离子与苯形成络合物,脱去一质子氢回到苯环结构。
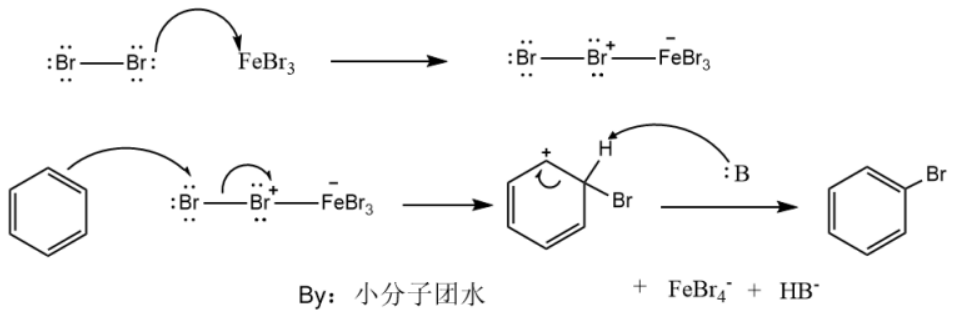
值得注意的是,对于付克烷基化反应,亲电试剂会生成碳正离子,可能会发生重排,得到的取代产物可能不是预想的结果。
【亲电加成反应】
亲电加成反应一般是指π电子与亲电试剂作用,消除该不饱和键的反应。相对σ键,π键较弱,容易给亲电试剂提供电子。亲电加成反应主要有碳正离子机理、环鎓离子机理、离子对机理以及三中心过渡态机理,这里我主要介绍前两种机理。
(碳正离子机理)
与自由基加成反应不同,亲电加成反应大多数都符合符合马氏规则。先看一下经由碳正离子历程的亲电加成。进攻的亲电试剂是卤化氢一般发生的是碳正离子机理,质子氢从卤离子上脱去,破坏较弱的π键,产生中间体碳正离子,然后亲电试剂的负电部分卤离子加成到碳正离子上。值得注意的是卤离子和碳正离子形成卤代烷速率非常快,该反应的最终速度取决于碳正离子生成的那一步。卤离子进攻碳正离子的方向不同,也会有顺式加成和反式加成两种产物。由于中间体有碳正离子生成,可能会发生碳正离子的重排现象。
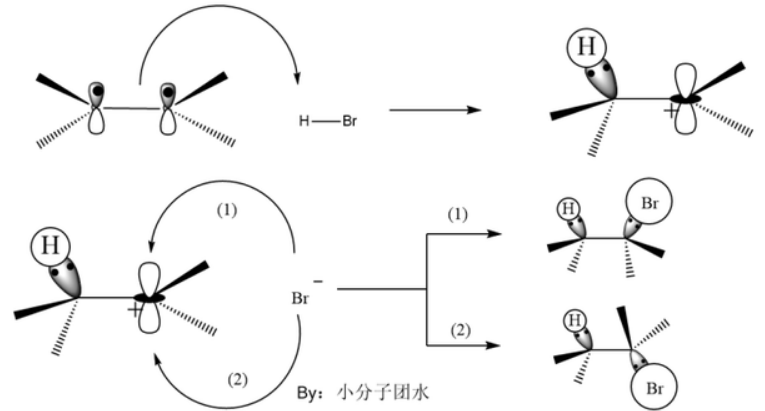
(鎓离子机理)
产生鎓离子机理的进攻试剂一般是卤素。溴分子靠近π键时,受到π电子云吸引,产生极化,π键打开与溴正离子形成了比较稳定的环溴鎓离子中间体和溴负离子。由于空间位阻,溴负离子从背面进攻其中的一个碳,破坏环状结构生成反式的邻二溴烃,此步的反应较快,因此反应的决速步骤是形成环鎓离子中间体。
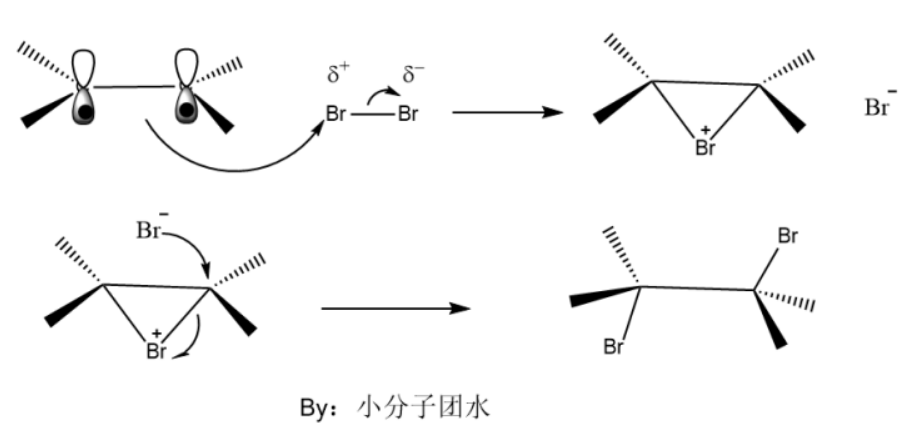
如图是环溴鎓离子中间体,溴负离子只能从背面进攻其中一个碳。
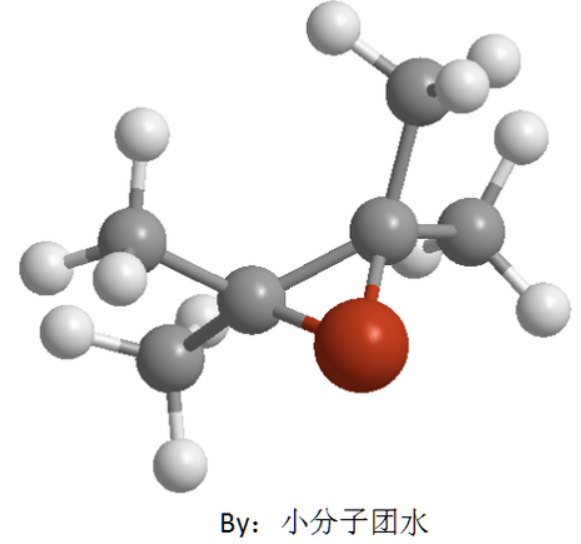
对比与碳正离子机理,鎓离子机理的最终产物是反式的邻二卤化烃,而前者顺反两种都有,环鎓离子不会有前者的重排现象。两者的决速步骤都是第一步反应。
【亲核取代反应】
亲核取代反应一般发生在含有(C-X)的结构中,卤原子电负性比碳大,电子云偏向卤原子那端,碳带部分正电荷,从而容易被亲核试剂进攻发生该类反应。
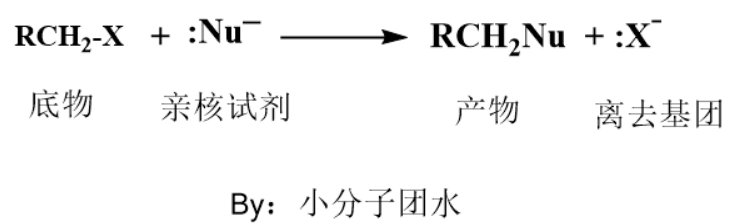
亲核取代反应分为单分子亲核取代反应(SN1反应)和双分子亲核取代反应(SN2反应)。下面具体介绍这2种机理。
(单分子亲核取代反应)
单分子亲核取代反应一般发生在叔碳和仲碳卤代烃,反应过程有碳正离子的生成,为2步反应。
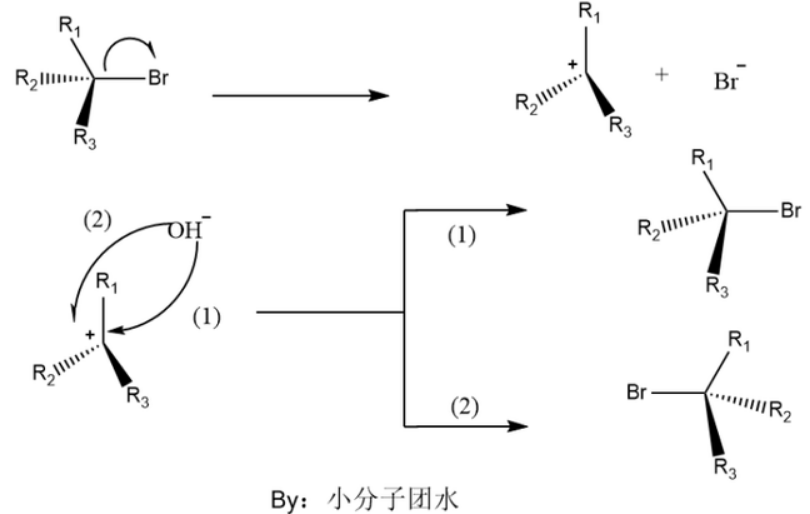
首先是离去基团离去,生成碳正离子,亲核试剂能够从两侧之一进攻碳正离子,机会都是50%。如果碳正离子原来是手性碳,则得到的产物是一部分保持原来的构型(如路径1),另一部分构型会反转(如路径2),产物表现为外消旋化。
单分子亲核取代反应的速率主要受底物浓度影响,亲核试剂的浓度对反应的速率影响并不大。反应的决速步是中间体碳正离子的生成。
(双分子亲核取代反应)
双分子亲核取代反应的特点是有反应是一步完成,生成产物。该反应一般发生在伯卤代烃和仲卤代烃之间,其反应速率受到底物和亲核试剂的双重影响。由于没有碳正离子生成,所以产物通常不会发生重排。
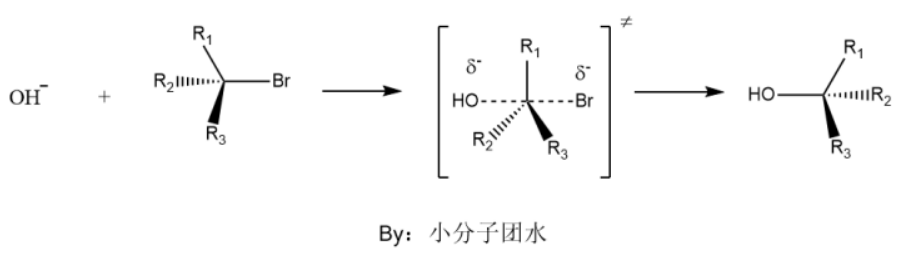
首先亲核试剂(此处用氢氧根举例)进攻α碳(由于溴原子的体积较大,亲核试剂从其背面进攻更为容易),形成高能量的过渡态,然后碳溴键完全断裂、碳氧键完全形成,就行了稳定的产物和离去基团溴离子,生成的产物构型发生了反转。
值得注意的是,SN1和SN2反应通常伴随着消除反应的发生,由于本文章主要介绍取代反应和加成反应,笔者将消除反应放在番外那里做简要介绍。
【亲核加成反应】
亲核加成反应的底物主要含羰基,由于氧的电负性高于碳,碳基碳带有一部分正电,从而容易吸引亲核试剂,发生反应。
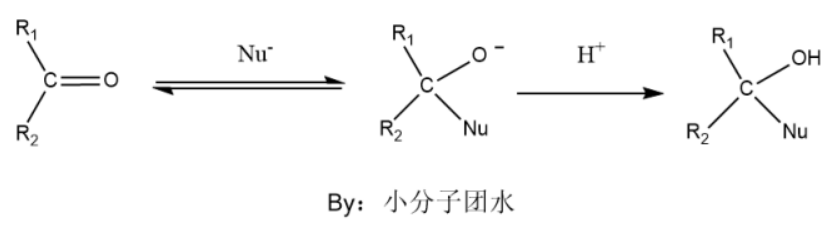
首先是亲核试剂进攻带有部分正电的羰基碳,π键断开形成氧负离子,然后氧负离子结合质子氢得到产物。值得注意的是亲核试剂进攻羰基碳是该反应的控速步,亲核加成反应的速率取决于被进攻碳的正电荷的多少和空间位阻。如果R基不是烷基而是空间大小适中的拉电子基团,反应速率会有明显的提升。
【消除反应】
消除反应常常和亲核取代反应是相互竞争,常见的消除反应有单分子消除反应(E1反应)、双分子消除反应(E2反应)、E1cb反应和热解消除反应。对于这四种机理,笔者在此只做简单介绍。
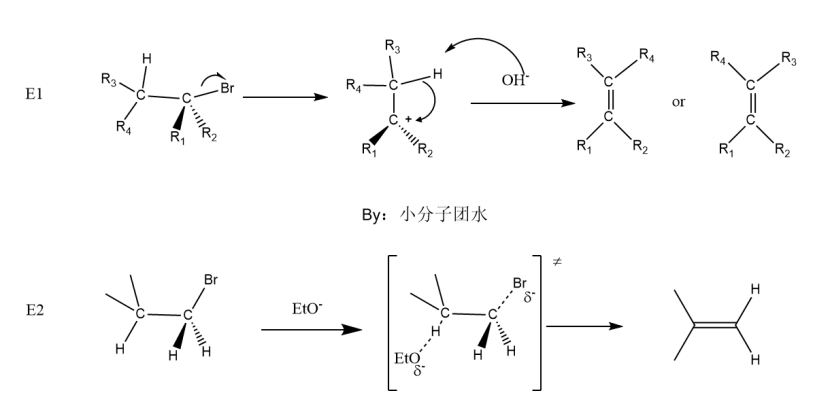
E1反应的机理是离去基团离去,生成碳正离子,同SN1反应是2步反应,这时候氢氧根发挥的是碱的作用,拔去β碳上的氢,β碳与碳正离子形成π键,产物有顺式和反式两种。β碳上的氢越多,碱性越强,离去基团越容易离去,则E1反应对SN1反应的干扰越大。
E2反应也和SN2反应一样要是一步反应,有过渡态。烷氧负离子结合β碳上的氢准备拔去,离去基团溴也准备离去,最后形成π键。
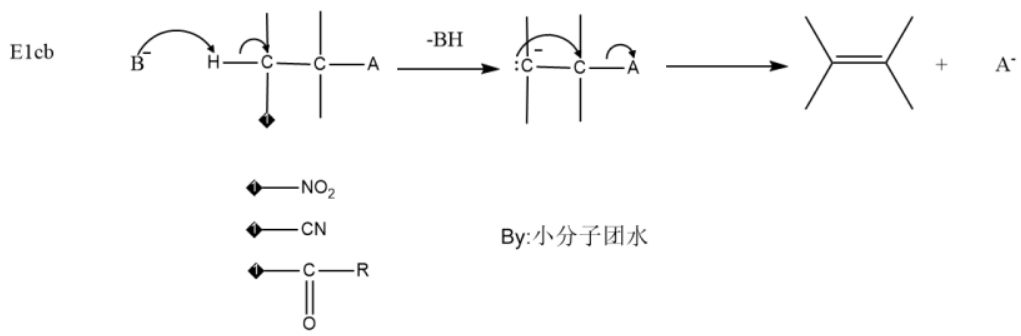
E1cb反应会有碳负离子生成,碱拔掉β碳上的氢,得到碳负离子,离去基团离去,形成双键。一般来说,β碳上连有强的吸电子基团会容易发生该反应。
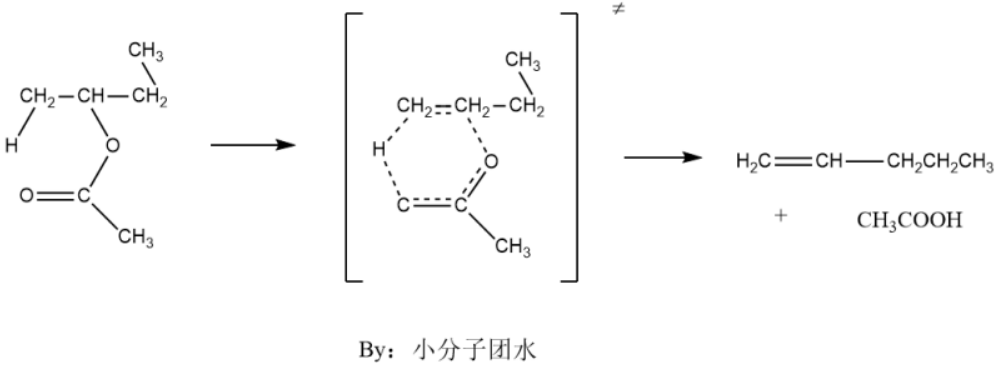
热解消除反应无需其他的试剂,在加热条件下,其自生会失去β碳上的氢和离去基团,是一种分解反应,其过程主要亮点是有一个环状过渡态。
关于消除反应和亲核取代反应,一般来说,试剂的亲核性越高越容易发生亲核取代反应,碱性越大越容易发生消除反应,β碳上的氢越多也越容易发生消除反应。反应是单分子和双分子则看试剂的极性,极性溶剂利于单分子反应,非极性溶剂利于双分子反应。

- 全部评论(0)
