有机化学基础讲座:醇类主要性质介绍
时间:2020-12-03 16:56 来源:未知 作者:化学自习室 点击: 次 所属专题: 醇类
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
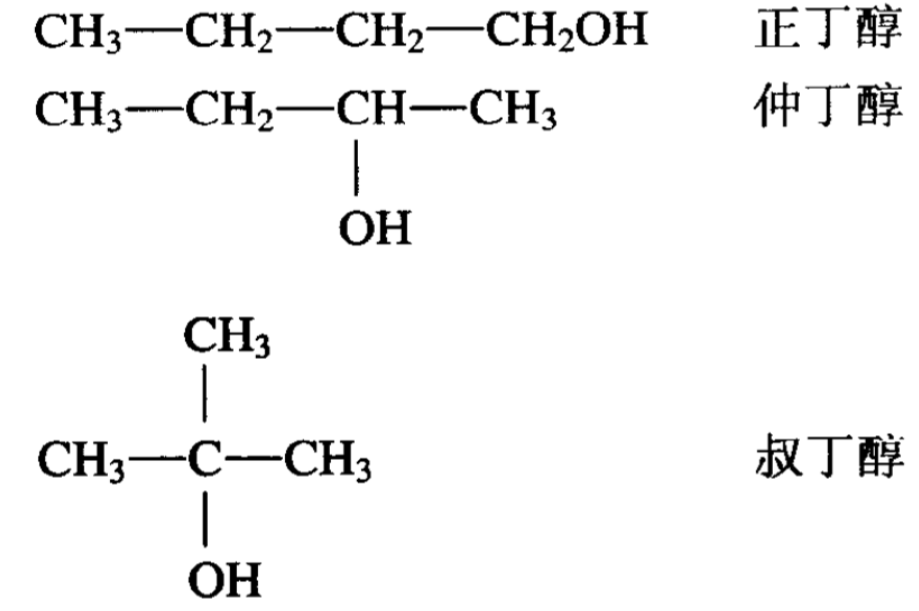
醇可以看作是脂肪烃分子中的氢被羟基(一OH)取代而生成 的化合物(R一OH),因此醇以羟基为其特征官能团。醇分子中只 含有一个羟基的叫一元醇,含有两个以上的羟基叫做多元醇。羟 基连接在第一碳原子上的称为第一醇(伯醇),羟基连接在第二碳 原子上的称为第二醇(仲醇),羟基连接在第三碳原子上的称为第 三醇(叔醇)。它们的结构式表示如下:
第一节:饱和一元醇的物理性质
4个碳以下的饱和一元醇是具有刺鼻气味的无色液体,5~11 个碳的为具有不愉快气味的油状液体,12个碳以上的为无臭的蜡状固体。
含有3个碳原子以下的醇可与水混溶,随着相对分子质量的 增大,在水中的溶解度迅速降低。如正丁醇在水中的溶解度仅8%, 高级醇则基本上不溶于水,因此醇也可被看作是水的烃化物 (H一OH, R一OH)。低级醇的羟基在分子中所占比例甚大,近似于水,因此可与水混溶;在中级醇分子中羟基所占比例减小, 而烃基所占比例迅速增大,所在水中的溶解度迅速减小。实验证明一个有机化合物可以溶解于与其结构或极性相似的溶剂内。例 如低级醇与水的结构相似所以可以溶解于水,而高级醇则基本上 与烃相似,所以不能溶于水,而可溶于石油醚内。
醇的沸点比与其相对分子质量相近的烷烃及卤代烃要高 得多。
例:
正庚烷:CH3(CH2)5CH3,相对分子质量100.20,沸点 98.40℃
1-氯代正戊烷:CH3(CH2)4Cl,相对分子质量106.60,沸点 105.7℃
正己醇:CH3(CH2)5OH,相对分子质量102.17,沸点155.8°C。
分子中的羟基,能使分子带有像水那样的电性质。就是说, 甲烷不能溶于水,而甲醇(有了羟基)就可以溶于水,而且甲醇和水是可以以任何比例混合的。
羟基还使化合物的沸点发生变化。羟基的电性质能使包含它 的各个分子微弱地粘结在一起。甲烷的各个分子(它不包含羟基) 互相是不粘结的。甲醇有羟基,使分子间“粘结”起来。所以, 要把它们分开而变成气体,就需要相当多的能量。甲醇的沸点是 64.7°C,比甲烷沸点高226.2°C,原因就在这里。
两个羟基粘结在一起,就形成一个氢键(某些其他的原子组合,也可以这样粘结)。氢键是怎样形成的呢?由于氧的电负性很 强,所以羟基中的氢氧键是高度极化的,结果使氧原子带有部分 负电荷,氢原子带有部分正电荷这就使一分子醇羟 基上的氢原子容易与另一分子醇羟基中的氧原子相接近。加以氢 原子的体积很小,因此,醇羟基中的氢原子除了直接与本分子中 的氧相键合外,还可与另一分子醇羟基的氧通过静电作用产生一 种新的结合力,这种结合力叫做氢键。氢键常用点线表示,以区 别于一般共价键。
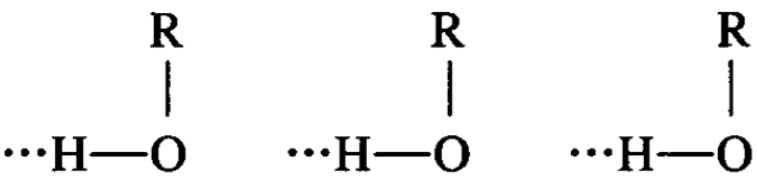
只有与负电性很强的原子连接的氢原子才能形成氢键。所以 在液态时,多分子醇可以通过氢键而缔合成不稳定的复分子。但 在气态时,则以单分子状态存在。氢键的键能比一般共价键的键能 要小得多,所以缔合成的复分子很容易被拆开成单分子。由于分子 间的缔合,所以醇的沸点和与其相对分子质量相近而不能形成氢键 的化合物相比要高得多。饱和一元醇的沸点和熔点等见下表。
饱和一元醇的物理常数
名称 | 分子式 | 溶点,°C | 沸点, | 密度,g/cm3 | 溶解度,g/L |
甲醇 | CH3OH | -97.1 | 64.7 | 0.791 | 混溶 |
乙醇 | C2H5OH | -114.1 | 78,3 | 0.789 | 混溶 |
丙醇 | C3H7OH | -127.0 | 91.2 | 0.803 | 混溶 |
丁醇 | C4H9OH | -89.8 | 117.7 | 0.809 | 8.00 |
戊醇 | C5H12OH | -78.5 | 138.0 | 0.814 | 2.70 |
己醇 | C6H13OH | -51.6 | 157.8 | 0.820 | 0.59 |
庚醇 | C7H15OH | -344.6 | 175.8 | 0.822 | 0.33 |
辛醇 | C8H17OH | -163 | 194.5 | 0.824 | 0.10 |
壬醇 | C9H19OH | -5.0 | 213.5 | 0.827 | 0.09 |
癸醇 | C10H21OH | -7.0 | 231.0 | 0.829 | |
十二醇 | C12H250H | 24.0 | 259.0 | 0.831 | |
十四醇 | C14H29OH | 38.0 | 167 | 0.823 | |
十六醇 | C16H33OH | 49.2 | 189.5 | 0.818 | |
十八醇 | C18H37OH | 59.0 | 210.5 | 0.812 |
第二节:醇的制法
格氏试剂和酮醛
还和环氧乙烷
卤代烃的水解
醛和酮的还原
乙缔水合变成醇
高温加氢变甲醇
醛的还原变丁醇
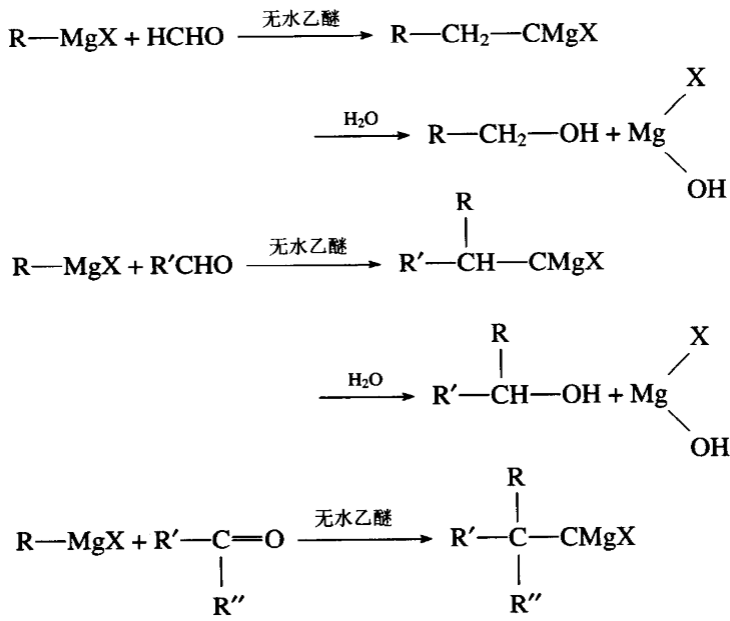
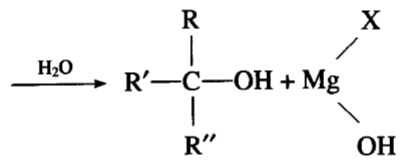
一、格氏试剂和酮醛
格氏试剂和甲醛作用生成第一醇,和其他醛作用生成第二醇,和酮作用生成第三醇。
二、还和环氧乙烷
格氏试剂与环氧乙烷加成
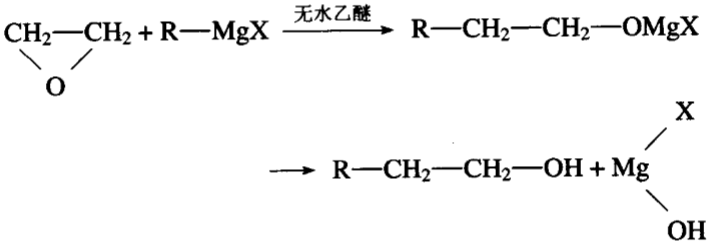
三、卤代烃的水解
![]()
四、醛和酮的还原
醛和酮的羰基可以和氢加成,分别生成第一醇和第二醇
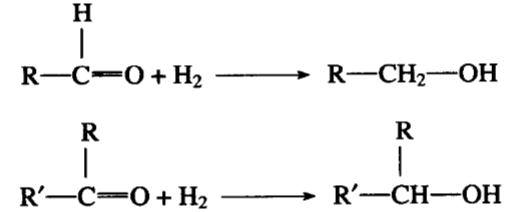
五、乙烯水合变成醇
乙烯可以从石油炼厂和裂解气中大量得到。乙烯的水合分为 直接水合法和间接水合法两种。
1.间接水合法
乙烯首先被硫酸所吸收,生成硫酸乙酯(CH3CH2OSO3H), 后者经水解即生成乙醇并释放出硫酸,反应过程可用下式表示:

2.直接水合法
乙烯和水在加热加压下,经催化剂作用,可直接水合生成乙醇:

六、高温加氢变甲醇
甲醇是一元醇系列中最简单的一个,制备甲醇的早期方法, 是在缺乏空气的条件下把木头加热。木头中的复杂分子分裂成为 许多较小的分子,并以气体状态挥发出来。这些气体不能在缺乏 空气的条件下燃烧。把这些气体收集来并使之液化,就可以得到 许多物质,其中包括甲醇在内。因此,甲醇有一个别名,叫做木 醇。它是无色透明的液体,与水能混溶,沸点64.7°C,不与水形 成恒沸混合物,因此可直接用蒸馏法得到无水甲醇。甲醇有毒, 口服10mL可使眼睛失明,25g 的量可使人死亡。
目前是将水煤气(含一氧化碳和氢气)在加压、加热下通过适当的催化剂来生产甲醇:
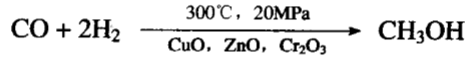
七、醛的还原变丁醇
丁醇有四种异构体,正丁醇、仲丁醇、异丁醇和叔丁醇。正丁 醇可由淀粉经特殊的酶发酵得到,产物中除含有60%的正丁醇外, 还有30%丙酮和10%乙醇。现在工业上由正丁醛还原制取正丁醇:
![]()
正丁醇为油状液体,沸点117°C,是合成增塑剂的重要原料。
第三节:醇的化学性质
氧化反应酮醛酸
脱水变成醛和酮
一、氧化反应酮醛酸
多元醇可以被氧化成不同氧化程度的含氧化合物,这在前面 已提到。
α-二醇氧化时容易在羟基相连的两个碳原子间断裂,变成醛、 酮或酸:
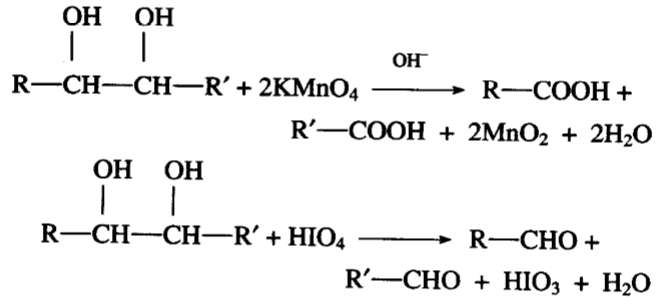
这是α-二醇的特性反应,可以利用这个反应鉴定α-二醇的结 构。显然也可以鉴定烯烃的结构,因为烯烃氧化时(在碱性高猛 钾溶液中)即在双键处加上两个羟基,然后再和高碘酸或四乙酸 铅作用,就发生上述反应。
二、脱水变成醛和酮
1.分子内脱水
一、二醇分子内脱水生成醛或酮,这是因为脱去一分子生成 的烯醇结构不稳定,立刻发生分子重排而成醛或酮:
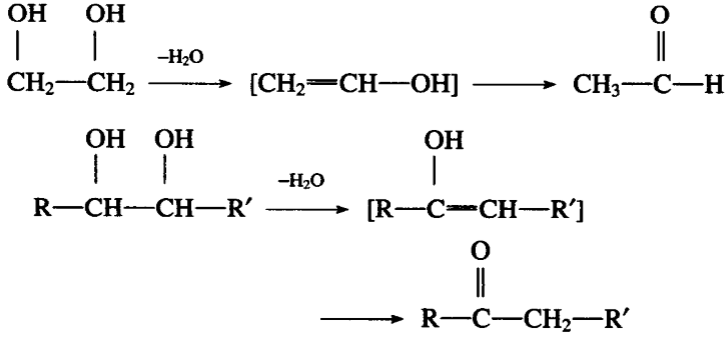
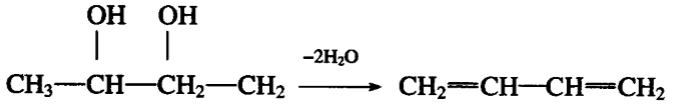
一、二醇分子内脱去两分子水生成具有共轭双键的二烯烃:
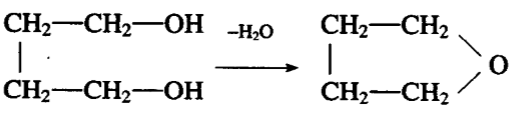
一、二醇及两个羟基相距更远的二醇分子内脱水生成环醚:
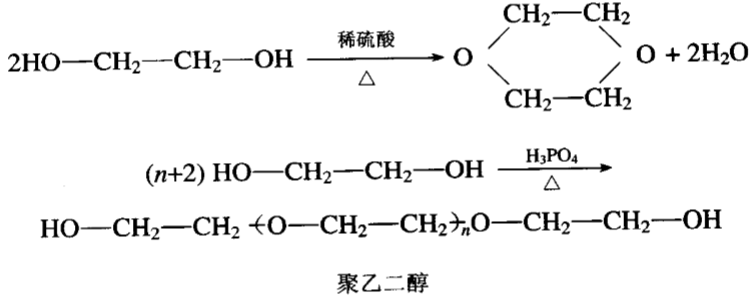
2.分子间脱水
二元醇脱水有2种方式,一种是分子间脱水生成环状化合物,另一种是多个分子间脱水形成一个长链化合物.•

- 全部评论(0)
