概念辨析:相对原子质量
时间:2023-01-02 16:08 来源:未知 作者:化学自习室 点击: 次 所属专题: 原子量
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
我们现在对于化学中的相对原子质量(Relative atomic mass),目前的理解都比较统一:
(任何一种原子的实际质量) / (碳12原子实际质量的1/12)
所以对这个“相对原子质量”的概念,要先理解“相对”的意思。数学上,相对是一个比值的概念,也就是说它一定包含了比值,也就是商式。回到定义的部分,实际质量是带有单位的物理量,化学上我们一般使用 g (克),这一点要区别于物理中质量的标准单位 kg(千克)。但无论是 g 也好,还是 kg ,又或者是其他形式的质量单位比如 mg ,在用比例式做比之后,单位都被约分掉了,结果就是相对原子质量没有单位,或者说单位为 1 。
其次,对于这个概念的理解重点是碳12原子。碳12原子实际只作为一个基准而已,我们用它的实际质量的 1/12 作为一个基数,其他原子的实际质量都和这个基数进行比较,得到的就是对应原子的相对原子质量。既然是一个基准,这里就存在一个天然的问题:这个基准是否可以更换?答案是可以。
我们纵观相对原子质量这个概念的发展史,就可以知道,这个基准一开始并不是碳12原子实际质量的 1/12 。这个基础在几经更换后,最终确定为现在使用的基准。
举 Na 原子的相对原子质量为例说明这个计算过程。
一个 Na 原子的实际质量为:3.8175 × 10 -23 g
一个C-12原子的实际质量为:1.9927 × 10 -23 g
所以 Na 的相对原子质量
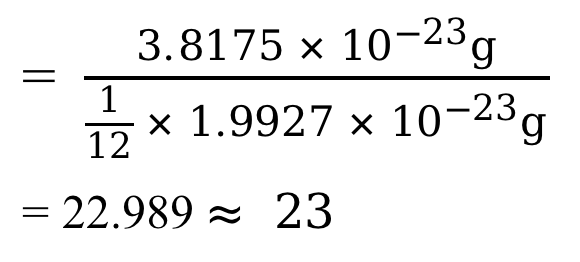
因此,我们在平时处理化学问题时,通常采用的 Na 的相对原子质量就是这么来的。
这个概念的发展史如下:
英国科学家道尔顿首次提出了“atomic weight”(原子量)的概念,并在1803年首次使用氢的原子量 1 作为相对原子量的基准。
1826年,永斯·贝采利乌斯改为氧原子量的 1/100 为基准。
1860年,J.-S.斯塔建议用氧原子量的1/16 为基准。
1929年,W.F.吉奥克和H.L.江斯登发现天然氧中存在着16O、17O、18O三种同位素,它们在自然界的分布不完全均匀,因此用天然氧作为原子量基准就欠妥。后来物理学界改用O的1/16 作为原子量基准,化学界还沿用原来的基准,从此原子量出现两种标度,1940年国际原子量委员会确定以1.000275作为两种标度的换算因子:物理原子量 = 1.000275 × 化学原子量。存在两种标度必然经常引起混乱。
1959年,在慕尼黑召开的国际纯粹暨应用物理学联合会(International Union of Pure and Applied Physics,简称IUPAP)上,德国J.H.马陶赫建议C=12.0000作为原子量基准,并提交国际纯粹与应用化学联合会考虑,后者于1960年接受这一建议。
1961年,在蒙特利尔召开的国际纯粹与应用化学联合会上,正式通过这一新基准。
1979年,由国际相对原子质量委员会提出原子量的定义。

- 全部评论(0)
