电离方程式的书写方法
时间:2023-03-05 17:59 来源:未知 作者:化学自习室 点击: 次 所属专题: 电离方程式
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
用化学式和离子符号等来表示物质离解成自由移动离子过程的式子叫做电离方程式。
书写方法步骤是左边写能电离物质的化学式,右边写电离后生成的离子符号,在阴、阳离子符号间用加号相连。根据方程式书写原则配平,使电离前后质量守恒,电量也守恒。如Ba(OH)2=Ba2++2OH-
书写电离方程式时应遵循下列原则:
1.质量守恒原则。即电离前后,元素种类、离子数目均未变。
2.电量平衡原则。即电离生成的阳离子所带正电荷总数与阴离子所带负电荷总数相等,整个溶液不显电性。
书写注意事项:
1.书写化学式与离子符号要正确无误,不能把离于符号和元素化合价符号混淆。
2.物质离解的部位是阴离子和阳离子结合处。当化学式中含原子团时,原子团应看作整体,不能拆开。如H2SO4=2H++SO42-。
3.化学式中含有多个原子团时,电离后原子团周围的括号要去掉,把表示离子个数的系数写在离子符号前。如Al2(SO4)3=2Al3++3SO42-
4.弱电解质在水中电离是部分电离,用可逆号;强电解质在水中电离是完全电离,用等号。如:
HClO H++ClO- HF
H++ClO- HF H++F-
H++F-
NaCl=Cl-+Na+
AgCl=Cl-+Ag+
HClO3= H++ClO3-
Mg(OH)2= Mg2++2OH-
C6H5ONa=C6H5O-+Na+
CH3COONH4= CH3COO-+NH4+
KAl(SO4)2=K++ 2SO42-+ Al3+
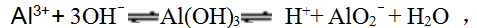
Al(OH)3为三元碱或一元酸
5.多元弱酸分步电离,多元弱碱中学一般一步电离彻底
H3PO4 H++H2PO4- H2PO4-
H++H2PO4- H2PO4- HPO2-+H+ HPO2-
HPO2-+H+ HPO2- H++PO43-
H++PO43-
Fe(OH)3 Fe3++3OH-
Fe3++3OH-
6.共价化合物液态时一般不电离,高中只认为纯水液态能电离,酸或水电离时可以写成H+也可以写成H3O+
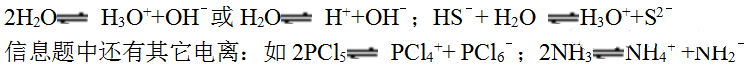
7.含离子键的化合物熔融时能完全电离,电离时断裂离子键,共价键不会断裂。
NaHSO4 Na++ HsO4-
Na++ HsO4-
8.酸式盐的电离
强酸的酸式盐完全电离。如:NaHSO4水溶液Na++ H++SO42-
弱酸的酸式盐分两次电离,第一步完全电离出的弱酸酸式酸根离子,弱酸酸式酸根离子再部分电离。如:
NaHCO3=Na++ HCO3- HCO3- H++HCO3-
H++HCO3-
9.配合物的电离
配合物一般分多步电离。配合物外界完全电离。
如:K3[Fe(CN)6]= 3K++[Fe(CN)6]3- ,Ag(NH3)2OH=Ag(NH3)2++ OH-;
配合物内界难电离,分步电离且各步都是部分电离。
![]()
10.特殊电离
Al(OH)3+H2O H++Al(OH)4-
H++Al(OH)4-
(它是一元酸的原因,有一配位键,硼酸类似)
11.难溶解于水的强电解质在水中溶解的部分是完全电离的,熔融时不分解的完全电离。
Al2O3 2Al3++ 3O2-
2Al3++ 3O2-
BaSO4 Ba2++SO42-
Ba2++SO42-
物质的电离是绝对的,不电离是相对的。完全电离也不都是百分之百,也有程度不同。同一物质在不同的溶剂里电离程度也有不同。这些都要看电离的条件。条件具备都有可能发生。
以上是中学化学里常见的一些电离方程式,大家在书写时要按照上述原则进行正确书写。

- 全部评论(0)
