怎么理解能量变化示意图
时间:2023-04-28 11:07 来源:未知 作者:化学自习室 点击: 次 所属专题: 反应能量图像
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
先说说放热反应和吸热反应。有同学错误地认为:“吸热反应是吸收了热量,所以反应体系的温度会升高”,这种理解刚好反了,放热或吸热指的是外界的感受。
对于吸热反应,它从外界吸收了热量转化为自身的化学能,外界因为热量少了导致了温度的降低,所以外界感到了寒冷。同理,对于放热反应,它把自身的化学能转化为热能释放出来,外界因为热量多了导致了温度的升高,所以外界感到了温暖。
在化学上,化学反应的能量变化可以用图示表述。接下来本文从宏观、微观、学科德育三个角度,谈谈对能量变化示意图的理解。
1.宏观表达
这是我们教材上第25页的能量变化示意图,是从宏观的角度表达的。
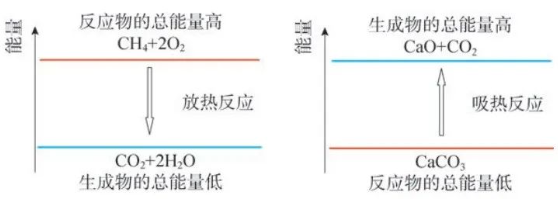
任何物质都有能量,能量只有变化时才能显示出来,它遵循着能量守恒定律。这种表达方式“以成败论英雄”——只讲结果,不讲过程。这种宏观表示也可以使用下图。
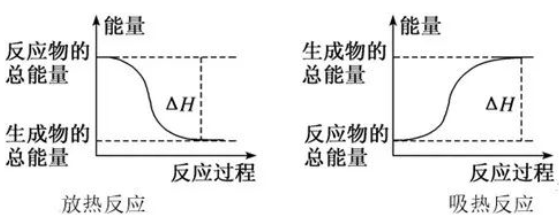
2.微观表达
从微观的角度看,化学反应的本质是化学键的断裂和生成。断裂原有的化学键需要吸收能量,生成新的化学键会放出能量,化学键的变化是化学反应中能量变化的主要原因。比如氢气和氯气反应生成氯化氢,微观过程是这样的:

用能量变化示意图可表示为:
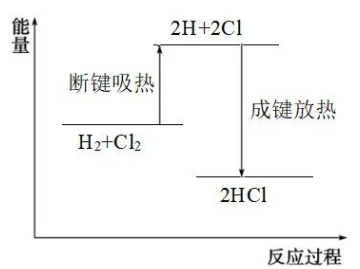
这种表达方式“先破后立”——断开反应物的化学键吸热能量,形成生成物的化学键放出能量,反应的热量变化就是二者的能量差。
3.过渡态理论的图示
还有一种图示能够体现化学反应的历程,它不同于前面各种表达形式。如图的E1是反应物的活化能,它不等于反应物的化学键键能。这是化学反应过渡态理论的图示。

这种图示“既看到了你的结果,也看到了你为此付出的努力”。化学反应往往是分多步进行的,要克服一个个障碍才能到达反应的终点。
过渡态理论认为,从反应物到生成物的变化过程中,必须要经过一个中间状态,这个中间状态叫过渡态,过渡态分子的平均能量与反应物分子平均能量的差值叫活化能。反应物分子自身的能量只有超越活化能才有可能发生反应。
4.需灵活处理的图示
如果图像如下,a指的是反应物总键能还是反应物的活化能呢?
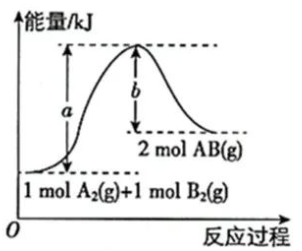
都有可能,只能根据题目的情境作出判断了。如果有“催化剂”出现,说明体现了化学反应历程,应理解为过渡态的图示,这时a指的是反应物的活化能。如果只有化学键的描述,说明这是从微观角度分析反应的,a指的就是反应物的总键能了。

- 全部评论(0)
