晨读笔记:钠及其化合物
时间:2023-08-09 15:48 来源:未知 作者:化学自习室 点击: 次 所属专题: 钠及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.金属钠是一种柔软、银白色、有金属光泽的金属,是热和电的良导体。
02.钠的密度比水的密度还小但比煤油的要大,会浮在水面上,沉在煤油底部。
03.钠原子最外层只有1个电子,在化学反应中钠原子很容易失去1个电子而形成稳定结构,因此金属钠的化学性质非常活泼,表现出很强的还原性
04.钠是非常活泼的金属,与O2反应,条件不同时,现象不同,产物也不同。
05.钠跟氧气常温下反应生成Na2O,加热(燃烧)生成Na2O2,Na2O加热时也可以转化为Na2O2。
06.金属钠在空气中点燃实验现象:熔化成小球,剧烈燃烧,产生黄色火焰,生成淡黄色固体。
07.钠跟硫能剧烈反应,研磨时甚至爆炸,2Na
+ S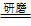 Na2S
Na2S
08.钠在氯气中燃烧产生白烟,火焰为黄色:2Na+Cl2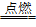 2NaCl
2NaCl
09.钠与氢气反应生成NaH:2Na+H2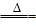 2NaH
2NaH
10.钠与水反应的现象及解释:
①浮:说明钠的密度比水的密度小
②熔:说明钠的熔点低;反应为放热反应
③游:说明有气体产生
④响:说明有气体产生
⑤红:溶液中滴入酚酞显红色,生成的溶液显碱性。
11.钠与水反应之前,要用滤纸吸干钠块表面的煤油,可防止钠与水反应放热而造成煤油燃烧
12.切割完钠块后,应将剩余的钠放入原试剂瓶中,取用钾时也要这样做。
13.由于钠、钾直接废弃容易造成失火或爆炸,为保证实验安全,放回原来的试剂瓶中比较合适。
14.钠、钾放回原试剂瓶,由于煤油的存在,也不会对原来保存的钠、钾造成污染。
15.白磷取用后,如果有剩余,也应放回原试剂瓶,原因是白磷易自燃。
16.其它的试剂取用后,如果有多余的,则不应放回原试剂瓶中,而应倒入指定的废液缸。
17.由于酸中H+浓度比水中H+浓度大得多,Na与酸溶液反应,比与水反剧烈,极易爆炸。
例如:2Na + 2HCl=2NaCl + H2↑;2Na + H2SO4=Na2SO4+H2↑
18.钠不能直接置换出盐溶液中的金属,而是先与水反应生成NaOH,再发生后续反应。
19.如钠投入到硫酸铜溶液中:2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑。
20.如钠投入到NH4Cl溶液中:2Na+2NH4Cl===2NaCl+2NH3↑+H2↑
21.钠与熔融的盐反应时,可置换出盐中较不活泼的金属。例如:4Na + TiCl4(熔融)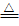 4NaCl + Ti
4NaCl + Ti
22.钠与与醇反应 2Na+2CH3CH2OH→2CH3CH2ONa + H2↑
23.由于钠的密度比煤油大且不与煤油反应,所以在实验室中通常将钠保存在煤油里,以隔绝与空气中的气体和水接触。
24.由于钠的性质很活泼,故钠在自然界中只能以化合态的形式(主要为NaCl,此外还有Na2SO4、Na2CO3、NaNO3等)存在。
25.Na的制备:工业上采用电解熔融的氯化钠来制备,2NaCl(熔融)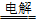 2Na+Cl2↑
2Na+Cl2↑
26.Na的用途:①制取Na2O2 ②K-Na合金作为核反应堆的导热剂 ③冶炼贵重金属 ④钠光源
27.Na-K合金(常温下为液态)作原子反应堆的导热剂的原因:Na---K合金熔点低、导热性好
28.制高压钠灯的原因:发出的黄色光射程远,透雾能力强。
29.Na2O是白色固体,碱性氧化物,具有碱性氧化物的通性,能与水、酸、酸性氧化物等反应。
30.Na2O2是淡黄色固体,不是碱性氧化物,能与水、酸、酸性氧化物等反应,具有强氧化性。
31.向盛有Na2O2粉末的试管中滴入少量水,产生大量气泡,试管壁温度升高,把带火星的木条放在试管口,木条复燃,向反应后的试管中滴入酚酞溶液,其现象是溶液先变红,后褪色。
32.由上述实验可知,过氧化钠与水反应有氧气和碱性物质生成,过氧化钠有漂白性。
33.Na2O2与CO2的反应:2Na2O2+2CO2===2Na2CO3+O2 (可用于O2的提供)
34.Na2O2与H2O、CO2反应都是Na2O2自身得失电子,即每1个Na2O2发生反应,转移1个电子,2Na2O2+2CO2==2Na2CO3+O2,2Na2O2+2H2O==4NaOH+O2↑,每生成1个O2转移2个电子。
35.在上述反应中,Na2O2既是氧化剂又是还原剂,H2O或CO2只作反应物,不参与氧化还原反应。
36.能够与Na2O2反应产生O2的,可能是CO2、水蒸气或CO2和水蒸气的混合气体。
37.Na2O2与一定量CO2和H2O(g)的混合物的反应,可视为先与CO2反应,再与H2O(g)反应。
38.Na2O2与HCl的反应:2Na2O2+4HCl===4NaCl+O2↑+2H2O
39.Na2O2中氧元素为—1价,处于中间价态,既有氧化性又有还原性,主要表现较强的氧化性
①Na2O2与SO2反应:Na2O2+SO2===Na2SO4
②Na2O2投入Na2SO3溶液中,可将SO32-氧化成SO42-
③Na2O2投入FeCl2溶液中,可将Fe2+氧化Fe3+,同时生成Fe(OH)3沉淀
④Na2O2投入氢硫酸中,可将H2S氧化成单质硫,溶液变浑浊
⑤Na2O2投入品红溶液中,因其有氧化性,所以有漂白性,可使品红溶液褪色
⑥Na2O2能使酚酞试液先变红(产生了碱)后褪色(漂白性),同时产生无色的气泡
40.氧化钠的化学式Na2O,O化合价是-2价;过氧化钠的化学式Na2O2,O化合价是-1价。
41.氧化钠和过氧化钠两种氧化物的阴阳离子个数比都是1:2。
42.2Na2O2+2H2O= 4NaOH+O2↑中每生成32g 氧气固体质量增加4g。
43.2Na2O2+2CO2=2Na2CO3+O2中每生成32g 氧气固体质量增加56g。
44.a g H2在O2中完全燃烧,燃烧产物通过足量的Na2O2固体,恰好能使Na2O2固体质量增加a g
45.a g CO在O2中完全燃烧,燃烧产物通过足量的Na2O2固体,恰好能使Na2O2固体质量增加a g
46.凡分子组成符合通式(CO)m(H2)n的物质,a g 该物质在O2中完全燃烧,将产物(CO2、H2O)通过足量的Na2O2固体,恰好能使固体质量增加a g。如CO、H2及CO与H2的混气、甲醛(CH2O)
47.Na2CO3白色粉,俗名纯碱、苏打,但它是盐不是碱。
48.碳酸钠结晶水合物的化学式为Na2CO3·10H2O,而NaHCO3是白色晶体.无结晶水合物。
49.Na2CO3易溶于水,NaHCO3溶于水,NaHCO3溶解度比Na2CO3小。
50.Na2CO3溶于水是放热的,NaHCO3溶于水是吸热的。
51.由于NaHCO3在水中的溶解度小于Na2CO3,1个Na2CO3能生成2个NaHCO3,且反应会消耗水,因此,向饱和的Na2CO3溶液中通入CO2气体,能析出NaHCO3晶体。
发生的化学反应方程式为:Na2CO3+CO2+H2O=2NaHCO3↓
52.Na2CO3加热不分解,而NaHCO3加热易分解。化学方程式为:2NaHCO3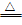 Na2CO3+CO2↑+ H2O
Na2CO3+CO2↑+ H2O
53.Na2CO3溶液中缓慢加入稀盐酸,并不断振荡,最初无明显现象,后产生气泡,是由于反应分两步进行:CO32-+ H+= HCO3-,HCO3-+ H+= CO2↑+ H2O。
54.NaHCO3与酸反应,立即放出CO2,HCO3-+ H+= CO2↑+H2O。
55.Na2CO3与NaHCO3的鉴别方法
①固态时:分别加热,能产生使澄清石灰水变浑浊气体的是NaHCO3。
②溶液中:分别加入CaCl2或BaCl2溶液,有白色沉淀产生的是Na2CO3。
③溶液中:逐滴加入稀盐酸,立即产生气泡的是NaHCO3,开始无现象,后有气泡的是Na2CO3。
56.Na2CO3与NaHCO3的相互转化关系是
Na2CO3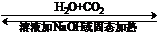 NaHCO3
NaHCO3
57.侯氏制碱法制NaHCO3和Na2CO3的原理: 在饱和NaCl溶液中依次通入足量的NH3、CO2气体,有NaHCO3从溶液中析出.有关反应的化学方程式为:
NH3+H2O+CO2=NH4HCO3
NH4HCO3+NaCl=NaHCO3↓+NH4Cl
2NaHCO3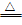 Na2CO3+H2O + CO2↑
Na2CO3+H2O + CO2↑
58.在饱和NaCl溶液中依次通入足量的NH3、CO2的原因是NH3在水溶液中的溶解度,吸收CO2更充分。
59.焰色实验:金属或它的化合物在灼烧时,火焰所呈现的特殊的颜色,是电子在灼烧时,吸收能量跃迁到高能级状态,再从高能级跃迁到低能级时,能量以一定波长的光释放出来的过程,所以焰色实验是物理变化过程。
60.焰色实验操作步骤:
洗:用盐酸洗铂丝;
烧:在酒精灯外焰中燃烧至与火焰颜色相同;
蘸:蘸取待测物;
烧:在火焰中燃烧,观察火焰的颜色。
61.常见焰色:Na-黄色、K-紫色(透过蓝色钴玻璃)、钙-砖红色、铜-绿色、钡-黄绿色
62.没有铂丝用铁丝也可以(铁丝灼烧不会产生焰色,对实验无干扰),铂丝用盐酸清洗的原因是金属氯化物沸点相对较低,在高温情况下易气化而挥发,不影响观察到的颜色。
37.碱金属元素包括锂(Li)、钠(Na)、钾(K)、铷(Rb)、铯(Cs)和放射性元素钫(Fr)。
38.碱金属的物理性质
(1)相似性:
①都具有银白色金属光泽(其中铯略带金黄色);
②柔软;
③熔点低;
④密度小,其中Li、Na、K的密度小于水的密度;
⑤导电、导热性好。
(2)递变规律:从Li → Cs,核电荷数的递增,密度逐渐增大(但K反常),熔点、沸点逐渐降低。
39.碱金属与O2等非金属反应.从Li → Cs,与O2反应的剧烈程度逐渐增加。
40.Li与O2反应只生成Li2O:4L i
+ O2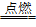 2L i2O
2L i2O
41.在室温下, K、Rb、Cs与O2反应生成相应的超氧化物KO2、RbO2、CsO2。
42.碱金属与H2O反应.发生反应的化学方程式可表示为:
2R + 2H2O = 2ROH + H2↑ (R代表Li、Na、K、Rb、Cs).
从Li→Na,与H2O反应的剧烈程度逐渐增加.
K与H2O反应时能够燃烧并发生轻微爆炸;
Rb、Cs遇H2O立即燃烧并爆炸.
生成的氢氧化物的碱性逐渐增强(其中LiOH难溶于水).

- 全部评论(0)
