化学反应速率方程和反应历程
时间:2023-08-11 09:11 来源:未知 作者:化学自习室 点击: 次 所属专题: 速率方程
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应速度与诸多因素相联系,如反应物浓度、体系温度和有无催化剂等。质量作用定律解决了浓度对反应速率的关系问题。一般而言,大多数化学反应随温度的升高而加快,随温度下降而变慢。日常生活中,夏季的时候要将食物储存在冰箱,就是为了降低反应速率防止食物腐败。
温度与反应速率的定量关系究竟如何?1884年,范特霍夫根据温度对反应速率的影响的实验,得出了一个近似规律:温度每升高10K,一般反应速率大约增加2~3倍。这个规则的估算显得过于粗略,且不能说明为何升高同样的温度,不同的反应其反应速率增大的程度并不一致。
1889年,阿累尼乌斯在德国莱比锡奥斯特瓦尔德的物理化学实验室工作,发表了“在酸作用下蔗糖转化的反应速率”的论文。实验测得,常温下温度每升高1K,反应速率约增加10~15%。
阿累尼乌斯通过理论计算,温度每升高1K,分子间碰撞频率也就增加2%左右,实验测得的数值之大是温度引起所有分子运动增加(碰撞更频繁)的规律无法说明的,况且温度引起的反应速率的增加是以几何级数而不是算术级数变化的。
因此,不能把温度对反应速率的影响的实质看作是普通物理性质的温度变化,其中必存在与反应有关的物理量。
阿累尼乌斯设想,在化学反应体系中,存在不同于一般反应物分子的“活化分子”,这个想法很可能来自他的电离理论,他最初把溶质在溶剂中的“电离”称为“活化”。
“活化分子”才是真正参加反应的物质,其浓度随温度升高而显著增大,即非活化的分子在温度升高时吸收一定的热量(活化热)转化为活化分子,这类分子碰撞才引起化学反应,活化热又称为活化能,用Ea表示。
根据这一假设,阿累尼乌斯推导出反应速率常数k与反应温度T的关系式:
k = A*e-Ea/RT 或 lnk = -Ea/(RT) + B(lnA)
该式又被称为阿累尼乌斯化学反应速率方程。A为指数前因子,它与单位时间内反应物的碰撞频率有关,也与碰撞时分子取向的可能性(分子的复杂程度)有关,R是气体常数,Ea为活化能,T为热力学温度。
原先A被当成是与温度无关的因子,而后来的实验证明,A并非与温度完全无关,速率常数k与e-Ea/RT的指数关系则是无疑的,阿累尼乌斯的工作使化学反应速率理论的发展迈出了具有决定性意义的一步。范特霍夫总结的近似规律算是敲门砖,速率方程则是登堂入室了。
质量作用定律和阿累尼乌斯速率方程分别揭示了反应速率和反应物浓度、反应温度之间的定量关系。接下来该是探讨化学反应的过程(机理)的时候,这也是反应速率理论最主要的核心。1889年,在化学反应速率方程之后,阿累尼乌斯提出了化学反应的碰撞理论。
童鞋大概还记得,古德贝格和瓦格是用分子碰撞的观点得出质量作用定律的,但阿童鞋的碰撞理论有所不同,它基于以下两个假设,分子间若要发生化学反应必须碰撞;其次,并非所有碰撞都能发生反应,只要那些平均动能足够大且正好碰到能起反应的部位才能引起反应(有点像生物学的供体和受体)。
一般而言,结构越复杂的分子之间的反应,这种情况越突出,它们的反应通常比较慢(碰撞其反应部位的几率比较小)。例如反应:
CO(g)+H2O(g)= CO2 (g)+ H2(g)
在CO分子中的碳原子与中的H2O氧原子迎头碰撞才能引起反应。如图。
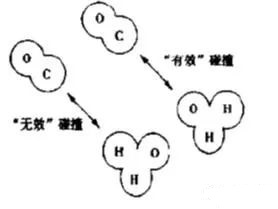
由气体分子运动论可计算出分子的碰撞频率与有效碰撞所占的百分比,1884年,玻尔兹曼曾企图用分子运动论计算反应速率,不过他没有考虑到碰撞大多是无效碰撞(不发生反应),阿累尼乌斯则提出了“活化能”和“活化分子”的概念,并推导出速率方程,但对活化分子以及碰撞过程未能给出确切的定义与明确的物理模型。
19世纪末,德国物理学家洛施密特将“活化分子”解释为反应气体中那些具有比分子平均速率更大的速率的分子,即把“活化能”归结于部分反应分子的平均动能增加。
1918年,英国化学家沃·路易斯将双分子碰撞理论概括为:只有反应物分子对的相对碰撞动能达到或超过某一临界值(阈值)才能发生反应,反应速率等于有效碰撞数,一般的反应历程可表述为:
A + B →(A + B)﹡ → 产物
以分子的动能E为横坐标,将具有一定动能间隔△E的分子分数(△N/N)与能量间隔之比为纵坐标作图(N为总分子数,△N为在该能量区间的分子数),可得到一定温度下的气体分布的能量曲线:
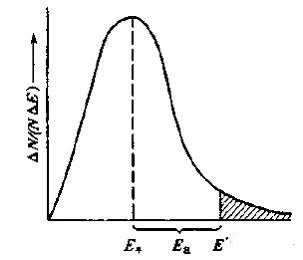
活化能Ea = Eˊ- E平,Eˊ就是临界值,E平就是所有分子的平均动能,阴影部分表示活化分子占据所有分子N的比例,阴影面积越大,则活化分子比例越高。
一定温度下,活化能越小,则活化分子越多,单位时间内有效碰撞次数越多,反应速率越快。反之,活化能越大,则活化分子越小,单位时间内有效碰撞次数越小,反应速率越慢。
不同的反应具有不同的活化能,因此相同温度下不同的化学反应具有不同的反应速率。笼统来说,活化能不同是化学反应速率不同的原因。
碰撞理论比较直观地讨论了一般反应的过程,但仅限于处理气体双分子反应,又把分子当成刚性球体(只要这样才能运用气体分子运动论),忽略了分子的内部结构,对一些稍复杂的反应难以自圆其说。
20世纪30年代,美国化学家艾琳和柏兰尼应用量子力学和统计力学提出了化学反应的过渡态理论,仍以有效碰撞为发生反应的前提,反应分子有效碰撞后,首先形成一个过渡态(又称为活化络合物),它极不稳定,与原来的反应物很快建立起热力学平衡,又能进一步分解形成反应的产物,由活化络合物转变为产物的速率较慢,这才是对反应速率其决定性意义的一步。
1935年,艾琳推导出过渡态理论关于速率常数的普遍公式,对A + B = G + H 的反应,其反应历程可表示为:
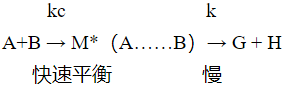
过渡态是反应物和产物之间的一种物质状态,也可以说是反应体系的始态和终态之间的一种状态。过渡态具有较高的势能,比反应物分子和产物分子的势能都要高,它形成反应过程中的一个势能垒。
反应物分子互相碰撞必须具有较高的能量足以克服这个势能垒,才能形成过渡态。以反应物A2和B2为例,当具有较高动能的A2和B2靠近时,随着其距离的缩短,分子动能逐渐转变为分子对之间的势能,原来的化学键断裂形成过渡态的活化络合物即A2B2,然后进一步分解为产物。如下图所示:
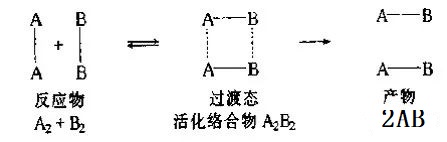
在过渡态理论中,所谓的活化能是反应发生时须克服的“势能垒”,这与碰撞理论中的活化能定义(具有高于所有分子平均动能的少数分子)有所不同,但实质是一样的—化学反应要发生,分子必须获得额外的能力克服外层电子间的排斥以发生有效碰撞。
过渡态理论把物质的微观结构与反应速率联系起来,又能计算活化能,比碰撞理论前进了一步,但是活化络合物的“寿命”极短,确定其物理模型相当困难,过渡态的能量计算极为复杂,虽然能解释大量化学反应,却不能预测任何现象,过渡态理论曾被风趣地称为“事后诸葛亮”。
20世纪,为解释更多的化学反应历程,除了上述两种理论外,还有链反应理论、自由基反应理论、单分子反应理论等等,随着极谱法、磁共振、闪光分解法、分子束、激光等新的实验方法的引入,化学反应积累了更多的实验数据,化学反应速率理论一直处于理论化学的最前沿。
20世纪诺贝尔化学奖的颁奖历史,有13次颁发给了22位直接对化学动力学发展做出巨大贡献的科学工作者,可见化学动力学在现代化学发展中的重要地位。

- 全部评论(0)
