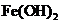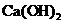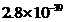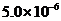2023年重庆市高考卷化学
时间:2023-10-08 06:54 来源:未知 作者:化学自习室 点击:次 所属专题: 新高考题库
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【2023重庆等级考】1. 重庆市战略性新兴产业发展“十四五”规划(2021-2025年)涉及的下列物质中,属于金属材料的是
|
|
|
|
A.重组蛋白 | B.高性能铜箔 | C.氮化镓半导体 | D.聚氨酯树脂 |
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.重组蛋白为有机物,A不符合题意;
B.合金、纯金属均为金属材料,铜为金属材料,B符合题意;
C.氮化镓半导体为新型无机非金属材料,C不符合题意;
D.聚氨酯树脂为有机合成材料,D不符合题意;
故选B。
【2023重庆等级考】2. 下列离子方程式中,错误 是
是
A. NO2通入水中: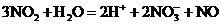
B. Cl2通入石灰乳中:
C. Al放入NaOH溶液中: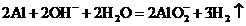
D. Pb放入Fe2(SO4)3溶液中:
【答案】B
【解析】
【详解】A.二氧化氮和水生成硝酸和NO,反应为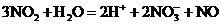 ,A正确;
,A正确;
B.石灰乳转化氢氧化钙不能拆,反应为 ,B错误;
,B错误;
C.Al放入NaOH溶液中生成偏铝酸钠和去: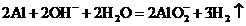 ,C正确;
,C正确;
D.Pb放入Fe2(SO4)3溶液中发生氧化还原生成二价铅和二价铁离子,反应为: ,D正确;
,D正确;
故选B。
【2023重庆等级考】3. 下列叙述正确的是
A. Mg分别与空气和氧气反应,生成的产物相同
B. SO2分别与H2O和H2S反应,反应的类型相同
C. Na2O2分别与H2O和CO2反应,生成的气体相同
D. 浓H2SO4分别与Cu和C反应,生成的酸性气体相同
【答案】C
【解析】
【详解】A.镁在空气中燃烧也会部分和氮气反应生成氮化镁,A错误;
B.SO2与H2O发生化合反应生成亚硫酸,而和H2S会发生氧化还原生成硫单质,反应的类型不相同,B错误;
C.Na2O2分别与H2O和CO2反应,生成的气体均为氧气,C正确;
D.浓H2SO4与Cu生成二氧化硫气体,而和C反应生成二氧化碳和二氧化硫,生成的酸性气体不相同,D错误;
故选C。
【2023重庆等级考】4. 已知反应:2F2+2NaOH=OF2+2NaF+H2O,NA为阿伏加德罗常数的值,若消耗44.8L(标准状况)F2,下列叙述错误的是
A. 转移的电子数为4NA B.生成的NaF质量为84g
C. 乙生成的氧化产物分子数为2NA D.生成的H2O含有孤电子对数为2NA
【答案】C
【解析】
【详解】A.反应2F2+2NaOH=OF2+2NaF+H2O中F的化合价由0价转化为-1价,O的化合价由-2价变为+2价,转移电子数为4e-,若消耗44.8L(标准状况)F2即44.8L÷22.4L/mol=2mol,故转移的电子数为4NA ,A正确;
B.根据反应2F2+2NaOH=OF2+2NaF+H2O,每消耗2molF2生成的NaF质量为2mol×42g/mol=84g,B正确;
C.根据反应2F2+2NaOH=OF2+2NaF+H2O可知反应生成的氧化产物为OF2,每消耗2molF2生成的氧化产物OF2分子数为NA ,C错误;
D.根据反应2F2+2NaOH=OF2+2NaF+H2O可知,每消耗2molF2生成H2O的物质的量为2mol,又知1个H2O中含有2对孤电子对,即生成的H2O含有孤电子对数为2NA ,D正确;
故答案为C。
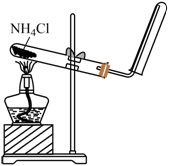
【2023重庆等级考】5. 下列实验装置或操作能够达到实验目的的是
A | B | C | D |
|
|
|
|
制取NH3 | 转移溶液 | 保护铁件 | 收集NO |
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.氯化铵受热分解为氨气和氯化氢,两者遇冷又会生成氯化铵,不适合制取氨气,A不符合题意;
B.转移溶液时玻璃棒应该伸入容量瓶刻度线以下,正确,B符合题意;
C.保护铁件应该连接比铁更活泼 金属使得铁被保护,而不是连接惰性电极石墨,C不符合题意;
金属使得铁被保护,而不是连接惰性电极石墨,C不符合题意;
D.NO会与空气中氧气反应,不适合排空气法收集,D不符合题意;
故选B。
【2023重庆等级考】6. “嫦娥石”是中国首次在月球上发现的新矿物,其主要由Ca、Fe、P、O和Y(钇,原子序数比Fe大13)组成,下列说法正确的是
A. Y位于元素周期表的第ⅢB族
B. 基态Ca原子的核外电子填充在6个轨道中
C. 5种元素中,第一电离能最小的是Fe
D. 5种元素中,电负性最大的是P
【答案】A
【解析】
【详解】A.钇原子序数比Fe大13,为39号元素,为元素周期表的第五周期第ⅢB族,A正确;
B.钙为20号元素,原子核外电子排布为1s22s22p63s23p64s2,基态Ca原子的核外电子填充在10个轨道中,B错误;
C.同一主族随原子序数变大,原子半径变大,第一电离能变小;同一周期随着原子序数变大,第一电离能变大,5种元素中,钙第一电离能比铁小,C错误;
D.同周期从左到右,金属性减弱,非金属性变强,元素的电负性变强;同主族由上而下,金属性增强,非金属性逐渐减弱,元素电负性减弱;5种元素中,电负性最大的是O,D错误;
故选A
【2023重庆等级考】7. 橙皮苷广泛存在于脐橙中,其结构简式(未考虑立体异构)如下所示:

关于橙皮苷的说法正确的是
A. 光照下与氯气反应,苯环上可形成C-Cl键
B. 与足量NaOH水溶液反应,O-H键均可断裂
C. 催化剂存在下与足量氢气反应,π键均可断裂
D. 与NaOH醇溶液反应,多羟基六元环上可形成π键
【答案】C
【解析】
【详解】A.光照下烃基氢可以与氯气反应,但是氯气不会取代苯环上的氢,A错误;
B.分子中出苯环上羟基,其他羟基不与氢氧化钠反应,B错误;
C.催化剂存在下与足量氢气反应,苯环加成为饱和碳环,羰基氧加成为羟基,故π键均可断裂,C正确;
D.橙皮苷不与NaOH醇溶液反应,故多羟基六元环不可形成π键,D错误;
故选C。
【2023重庆等级考】8. 下列实验操作和现象,得出的相应结论正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 向盛有Fe(OH)3和NiO(OH)的试管中分别滴加浓盐酸 | 盛NiO(OH)的试管中产生黄绿色气体 | 氧化性:NiO(OH)>Fe(OH)3 |
B | 向CuSO4溶液中通入H2S气体 | 出现黑色沉淀(CuS) | 酸性:H2S<H2SO4 |
C | 乙醇和浓硫酸共热至170℃,将产生的气体通入溴水中 | 溴水褪色 | 乙烯发生了加成反应 |
D | 向Na2HPO4溶液中滴加AgNO3溶液 | 出现黄色沉淀(Ag3PO4) | Na2HPO4发生了水解反应 |
A. A B. B C. C D. D
【答案】A
【解析】
【详解】A.氧化剂氧化性大于氧化产物,盛NiO(OH)的试管中产生黄绿色气体,说明NiO(OH)将氯离子氧化为氯气,而氢氧化铁不行,故氧化性:NiO(OH)>Fe(OH)3,A正确;
B.出现黑色沉淀(CuS),是因为硫化铜的溶解度较小,不能说明酸性H2S<H2SO4,B错误;
C.挥发的乙醇也会被强氧化剂溴单质氧化使得溴水褪色,不能说明乙烯发生了加成反应,C错误;
D.出现黄色沉淀(Ag3PO4),说明Na2HPO4电离出了磷酸根离子,D错误;
故选A。
【2023重庆等级考】9. 配合物[MA2L2]的分子结构以及分子在晶胞中的位置如图所示,下列说法错误的是
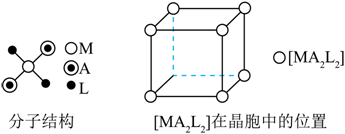
A. 中心原子的配位数是4 B.晶胞中配合物分子的数目为2
C. 晶体中相邻分子间存在范德华力 D.该晶体属于混合型晶体
【答案】D
【解析】
【详解】A.由题干配合物[MA2L2]的分子结构示意图可知,中心原子M周围形成了4个配位键,故中心原子M的配位数是4,A正确;
B.由题干图示晶胞结构可知,晶胞中配合物分子的数目为8×(1/8)+2×(1/2)=2,B正确;
C.由题干信息可知,该晶体为由分子组成的分子晶体,故晶体中相邻分子间存在范德华力,C正确;
D.由题干信息可知,该晶体为由分子组成的分子晶体,D错误;
故答案为:D。
【2023重庆等级考】10.NCl3和SiCl4均可发生水解反应,其中NCl3的水解机理示意图如下:

下列说法正确的是
A. NCl3和SiCl4均为极性分子 B.NCl3和NH3中的N均为sp2杂化
C. NCl3和SiCl4的水解反应机理相同 D.NHCl2和NH3均能与H2O形成氢键
【答案】D
【解析】
【详解】A.NCl3中中心原子N周围的价层电子对数为:3+ =4,故空间构型为三角锥形,其分子中正、负电荷中心不重合,为极性分子,而SiCl4中中心原子周围的价层电子对数为:4+
=4,故空间构型为三角锥形,其分子中正、负电荷中心不重合,为极性分子,而SiCl4中中心原子周围的价层电子对数为:4+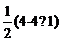 =4,是正四面体形结构,为非极性分子,A错误;
=4,是正四面体形结构,为非极性分子,A错误;
B.NCl3和NH3中中心原子N周围的价层电子对数均为:3+ =4,故二者N均为sp3杂化,B错误;
=4,故二者N均为sp3杂化,B错误;
C.由题干NCl3反应历程图可知,NCl3水解时首先H2O中的H原子与NCl3上的孤电子对结合,O与Cl结合形成HClO,而SiCl4上无孤电子对,故SiCl4的水解反应机理与之不相同,C错误;
D.NHCl2和NH3分子中均存在N-H键和孤电子对,故均能与H2O形成氢键,D正确;
故答案为:D。
【2023重庆等级考】11.(NH4)2SO4溶解度随温度变化的曲线如图所示,关于各点对应的溶液,下列说法正确的是
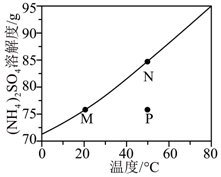
A. M点KW等于N点KW
B. M点pH大于N点pH
C. N点降温过程中有2个平衡发生移动
D. P点c(H+)+c(NH4+)+c(NH3·H2O)=c(OH-)+2c(SO42-)
【答案】B
【解析】
【详解】A.温度升高,水的电离程度增大,则M点KW小于N点KW,A错误;
B.升高温度促进铵根离子的电离,且N点铵根离子浓度更大,水解生成氢离子浓度更大,N点酸性更强,故M点pH大于N点pH,B正确;
C.N点降温过程中有水的电离平衡、铵根离子的水解平衡、硫酸铵的溶解平衡3个平衡发生移动,C错误;
D.P点为硫酸铵的不饱和溶液,由电荷守恒可知,c(H+)+c(NH4+)=c(OH-)+2c(SO42-),D错误;
故选B。
【2023重庆等级考】12. 电化学合成是一种绿色高效的合成方法。如图是在酸性介质中电解合成半胱氨酸和烟酸的示意图。下列叙述错误的是

A. 电极a为阴极
B. H+从电极b移向电极a
C. 电极b发生的反应为:
D. 生成3mol半胱氨酸的同时生成1mol烟酸
【答案】D
【解析】
【分析】该装置是电解池,电极b上3-甲基吡啶转化为烟酸过程中‘加氧少氢’,发生氧化反应,则b为阳极,a为阴极,阴极电极反应式为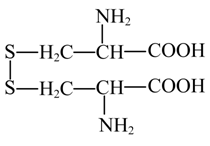 +2e-+2H+=2
+2e-+2H+=2 ;
;
【详解】A.a极上硫元素化合价升高,a为阴极,A正确;
B.电解池中阳离子移向阴极,则H+移向a电极,B正确;
C.电极b上3-甲基吡啶转化为烟酸过程中发生氧化反应,在酸性介质中电极反应式为: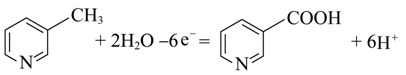 ,C正确;
,C正确;
D.根据电子守恒可得关系式: ~6e-~6
~6e-~6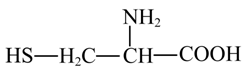 ,因此生成6mol半胱氨酸的同时生成1mol烟酸,D错误;
,因此生成6mol半胱氨酸的同时生成1mol烟酸,D错误;
故选:D。
【2023重庆等级考】13. 化合物X3Y7WR和X3Z7WR所含元素相同,相对分子质量相差7,1molX3Y7WR含40mol质子,X、W和R三种元素位于同周期,X原子最外层电子数是R原子核外电子数的一半。下列说法正确的是
A. 原子半径:W>R B.非金属性:X>R
C. Y和Z互为同素异形体 D.常温常压下X和W的单质均为固体
【答案】A
【解析】
【分析】化合物X3Y7WR和X3Z7WR所含元素相同,相对分子质量相差7,说明Y、Z为氢元素的两种核素,由题干信息可知,1molX3Y7WR含40mol质子,X、W和R三种元素位于同周期,X原子最外层电子数是R原子核外电子数的一半,则X、W、R的内层电子数为2,设X的最外层电子数为a,则R的核外电子数为2a,W的核外电子数为b,Y的质子数为1,则有:3(a+2)+ 2a+b+7=40(a、b均为整数),5a+b=27,解得a=5,b=2(X、R不在同周期,舍去);a=4,b=7;a=3,b=12(X、R不在同周期,舍去);则X为C,R为O,W为N。
【详解】A.同周期从左到右原子半径逐渐减小,则原子半径:W>R,故A正确;
B.同周期从左到右非金属性逐渐增强,则非金属性: R>X,故B错误;
C.Y和Z是氢的两种核素,两者互为同位素,故C错误;
D.常温常压下X的单质为固体,W的单质是气体,故D错误。
综上所述,答案为A。
【2023重庆等级考】14. 逆水煤气变换体系中存在以下两个反应:
反应Ⅰ:CO2(g)+H2(g) CO(g)+H2O(g)
CO(g)+H2O(g)
反应Ⅱ:CO2(g)+4H2(g) CH4(g)+3H2O(g)
CH4(g)+3H2O(g)
在恒容条件下,按 投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
投料比进行反应,平衡时含碳物质体积分数随温度的变化如图所示。下列说法正确的是
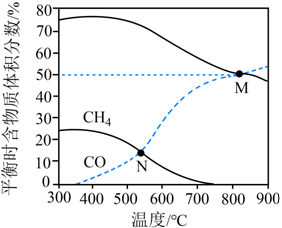
A. 反应Ⅰ的 ,反应Ⅱ的
,反应Ⅱ的
B. M点反应Ⅰ的平衡常数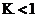
C. N点H2O的压强是CH4的3倍
D. 若按 投料,则曲线之间交点位置不变
投料,则曲线之间交点位置不变
【答案】C
【解析】
【详解】A.随着温度的升高,甲烷含量减小、一氧化碳含量增大,则说明随着温度升高,反应Ⅱ逆向移动、反应Ⅰ正向移动,则反应Ⅱ为放热反应焓变小于零、反应Ⅰ为吸热反应焓变大于零,A错误;
B.M点没有甲烷产物,且二氧化碳、一氧化碳含量相等,投料 ,则此时反应Ⅰ平衡时二氧化碳、氢气、一氧化碳、水的物质的量相等,反应Ⅰ的平衡常数
,则此时反应Ⅰ平衡时二氧化碳、氢气、一氧化碳、水的物质的量相等,反应Ⅰ的平衡常数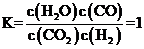 ,B错误;
,B错误;
C.N点一氧化碳、甲烷物质的量相等,结合反应方程式的系数可知,生成水得总的物质的量为甲烷的3倍,结合阿伏伽德罗定律可知,H2O的压强是CH4的3倍,C正确;
D.反应Ⅰ为气体分子数不变的反应、反应Ⅱ为气体分子数减小的反应;若按 投料,相当于增加氢气的投料,会使得甲烷含量增大,导致甲烷、一氧化碳曲线之间交点位置发生改变,D错误;
投料,相当于增加氢气的投料,会使得甲烷含量增大,导致甲烷、一氧化碳曲线之间交点位置发生改变,D错误;
故选C。
二、非选择题:本题共4小题,共58分。
【2023重庆等级考】15.Fe3O4是一种用途广泛的磁性材料,以FeCl2为原料制备Fe3O4并获得副产物CaCl2水合物的工艺如下。
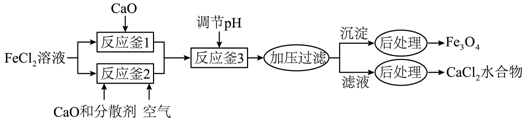
25℃时各物质溶度积见下表:
物质 |
|
|
|
溶度积 |
|
|
|
回答下列问题:
(1)Fe3O4中Fe元素的化合价是+2和_______。O2-的核外电子排布式为_______。
(2)反应釜1中的反应需在隔绝空气条件下进行,其原因是_______。
(3)反应釜2中,加入CaO和分散剂的同时通入空气。
①反应 离子方程式为_______。
离子方程式为_______。
②为加快反应速率,可采取的措施有_______。(写出两项即可)。
(4)①反应釜3中,25℃时,Ca2+浓度为5.0mol/L,理论上pH不超过_______。
②称取CaCl2水合物1.000g,加水溶解,加入过量Na2C2O4,将所得沉淀过滤洗涤后,溶于热的稀硫酸中,用0.1000mol/L KMnO4标准溶液滴定,消耗24.00mL。滴定达到终点的现象为_______,该副产物中CaCl2的质量分数为_______。
【答案】(1) ①. +3 ②. 1s22s22p6
(2)防止二价铁被空气中氧气氧化为三价铁
(3) ①.4CaO+6H2O+4Fe2++O2=4Fe(OH)3+4Ca2+ ②.适当升高温度、搅拌
(4) ①. 11 ②.最后半滴标准液加入后,溶液变为红色,且半分钟内不变色 ③. 66.6%
【解析】
【分析】FeCl2溶液加入氧化钙生成氢氧化亚铁,FeCl2溶液加入氧化钙和空气生成氢氧化铁,反应釜1、2中物质混合后调节pH,加压过滤分离出沉淀处理得到四氧化三铁,滤液处理得到氯化钙水合物;,
【小问1详解】
Fe3O4可以写成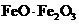 ,故Fe元素的化合价是+2和+3。O2-为氧原子得到2个电子形成的,核外电子排布式为1s22s22p6;
,故Fe元素的化合价是+2和+3。O2-为氧原子得到2个电子形成的,核外电子排布式为1s22s22p6;
【小问2详解】
空气中氧气具有氧化性,反应釜1中 反应需在隔绝空气条件下进行,其原因是防止二价铁被空气中氧气氧化为三价铁;
反应需在隔绝空气条件下进行,其原因是防止二价铁被空气中氧气氧化为三价铁;
【小问3详解】
①反应釜2中,加入CaO和分散剂的同时通入空气,氧气将二价铁氧化三价铁,三价铁与氧化钙和水生成的氢氧化钙生成氢氧化铁,反应的离子方程式为4CaO+6H2O+4Fe2++O2=4Fe(OH)3+4Ca2+。
②为加快反应速率,可采取的措施有适当升高温度、搅拌等;
【小问4详解】
①反应釜3中,25℃时,Ca2+浓度为5.0mol/L,反应不能使钙离子生成沉淀,防止引入杂质,故此时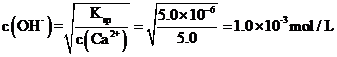 ,pOH=3,pH=11,故理论上pH不超过11。
,pOH=3,pH=11,故理论上pH不超过11。
②高锰酸钾溶液紫红色,故滴定达到终点的现象为:最后半滴标准液加入后,溶液变为红色,且半分钟内不变色;
氯化钙和草酸钠转化为草酸钙沉淀CaC2O4,草酸钙沉淀加入硫酸转化为草酸,草酸和高锰酸钾发生氧化还原反应: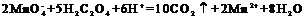 ,结合质量守恒可知,
,结合质量守恒可知, ,则该副产物中CaCl2的质量分数为
,则该副产物中CaCl2的质量分数为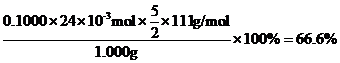 。
。
【2023重庆等级考】16. 煤的化学活性是评价煤气化或燃烧性能的一项重要指标,可用与焦炭(由煤样制得)反应的CO2的转化率α来表示。研究小组设计测定α的实验装置如下:

(1)装置Ⅰ中,仪器a的名称是_______;b中除去的物质是_______(填化学式)。
(2)①将煤样隔绝空气在900℃加热1小时得焦炭,该过程称为_______。
②装置Ⅱ中,高温下发生反应的化学方程式为_______。
③装置Ⅲ中,先通入适量的气体X,再通入足量Ar气。若气体X被完全吸收,则可依据d和e中分别生成的固体质量计算α。
i.d中的现象是_______。
ii.e中生成的固体为Ag,反应的化学方程式为_______。
iii.d和e的连接顺序颠倒后将造成α_______(填“偏大”“偏小”或“不变”)。
iiii.在工业上按照国家标准测定α:将干燥后的CO2(含杂质N2的体积分数为n)以一定流量通入装置Ⅱ反应,用奥氏气体分析仪测出反应后某时段气体中CO2的体积分数为m,此时α的表达式为_______。
【答案】(1) ①. 分液漏斗 ②. HCl
(2) ①. 干馏 ②.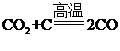 ③.有白色沉淀生成 ④.
③.有白色沉淀生成 ④. 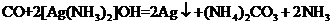 ⑤.偏大 ⑥.
⑤.偏大 ⑥. 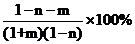
【解析】
【分析】稀盐酸与碳酸钙反应生成二氧化碳、氯化钙和水,由于盐酸易挥发,二氧化碳中含有氯化氢杂质,用饱和碳酸氢钠溶液吸收氯化氢,再用浓硫酸干燥气体,二氧化碳通到灼热的焦炭中反应生成一氧化碳,将混合气体通入足量氢氧化钡溶液中吸收二氧化碳,一氧化碳与银氨溶液反应生成银单质。
【小问1详解】
装置Ⅰ中,仪器a的名称是分液漏斗;由于二氧化碳中含有挥发的氯化氢气体,因此b中碳酸氢钠与氯化氢反应,则除去的物质是HCl;故答案为:分液漏斗;HCl。
【小问2详解】
①将煤样隔绝空气在900℃加热1小时得焦炭,即隔绝空气加强热使之分解,则该过程称为干馏;故答案为:干馏。
②装置Ⅱ中,高温下二氧化碳和焦炭反应生成一氧化碳,其发生反应的化学方程式为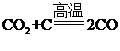 ;故答案为:
;故答案为: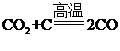 。
。
③i.d中二氧化碳和氢氧化钡反应生成碳酸钡沉淀和水,其反应的现象是有白色沉淀生成;故答案为:有白色沉淀生成。
ii.e中生成的固体为Ag,根据氧化还原反应分析得到CO变为碳酸铵,则反应的化学方程式为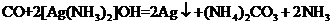 ;故答案为:
;故答案为: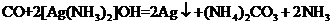 。
。
iii.d和e的连接顺序颠倒,二氧化碳和银氨溶液反应,导致银氨溶液消耗,二氧化碳与氢氧化钡反应的量减少,则将造成α偏大;故答案为:偏大。
iiii.在工业上按照国家标准测定α:将干燥后的CO2(含杂质N2的体积分数为n)以一定流量通入装置Ⅱ反应,用奥氏气体分析仪测出反应后某时段气体中CO2的体积分数为m,设此时气体物质的量为bmol,二氧化碳物质的量为bmmol,原来气体物质的量为amol,原来二氧化碳物质的量为a(1−n)mol,氮气物质的量为anmol,则消耗二氧化碳物质的量为[a(1−n)
−bm]mol,生成CO物质的量为2[a(1−n) −bm]mol,则有b=an+bm+2[a(1−n)
−bm],解得: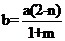 ,此时α的表达式为
,此时α的表达式为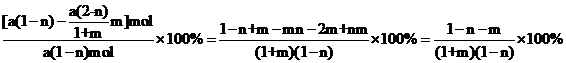 ;故答案为:
;故答案为: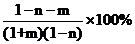 。
。
【2023重庆等级考】17. 银及其化合物在催化与电化学等领域中具有重要应用。
(1)在银催化下,乙烯与氧气反应生成环氧乙烷(EO)和乙醛(AA)。根据图所示,回答下列问题:

①中间体OMC生成吸附态EO(ads)的活化能为_______kJ/mol。
②由EO(g)生成AA(g)的热化学方程式为_______。
(2)一定条件下,银催化剂表面上存在反应:Ag2O(s) 2Ag(s)+1/2O2(g),该反应平衡压强Pc与温度T的关系如下:
2Ag(s)+1/2O2(g),该反应平衡压强Pc与温度T的关系如下:
| 401 | 443 | 463 |
| 10 | 51 | 100 |
①463K时的平衡常数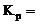 _______
_______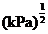 。
。
②起始状态Ⅰ中有Ag2O、Ag和O2,经下列过程达到各平衡状态:

已知状态Ⅰ和Ⅲ的固体质量相等,下列叙述正确的是_______(填字母)。
A.从Ⅰ到Ⅱ的过程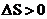
B.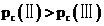
C.平衡常数:
D.若体积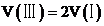 ,则
,则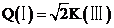
E.逆反应的速率: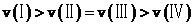
③某温度下,向恒容容器中加入Ag2O,分解过程中反应速率 与压强P的关系为
与压强P的关系为 ,k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则
,k为速率常数(定温下为常数)。当固体质量减少4%时,逆反应速率最大。若转化率为14.5%,则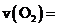 _______(用K表示)。
_______(用K表示)。
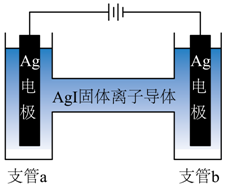
(3)α-AgI可用作固体离子导体,能通过加热γ-AgI制得。上述两种晶体的晶胞示意图如图所示(为了简化,只画出了碘离子在晶胞中的位置)。

①测定晶体结构最常用的仪器是_______ (填字母)。
A.质谱仪 B.红外光谱仪 C.核磁共振仪 D.X射线衍射仪
②γ-AgI与α-AgI晶胞的体积之比为_______。
③测定α-AgI中导电离子类型的实验装置如图所示。实验测得支管a中AgI质量不变,可判定导电离子是Ag+而不是I-,依据是_______。
【答案】(1) ①. 83 ②.EO(g)=AA(g) ΔH=-102kJ/mol
(2) ①. 10 ②.
CDE ③. 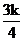
(3) ①. D ②. 12:7 ③. a中银电极质量减小,b中银电极质量增大
【解析】
【小问1详解】
①过渡态物质的总能量与反应物总能量的差值为活化能,中间体OMC生成吸附态EO(ads)的活化能为 。
。
②由图可知,EO(g)生成AA(g)放出热量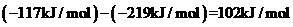 ,放热焓变为负值,故热化学方程式为EO(g)=AA(g) ΔH=-102kJ/mol;
,放热焓变为负值,故热化学方程式为EO(g)=AA(g) ΔH=-102kJ/mol;
【小问2详解】
①反应中只有氧气为气体,结合表格数据可知,463K时的平衡常数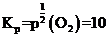
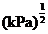 。
。
②结合表格数据可知,升高温度,压强变大,平衡正向移动,则反应为吸热反应;
A.从Ⅱ到Ⅲ为体积增大,反应正向移动的过程,导致固体质量减小,已知状态Ⅰ和Ⅲ的固体质量相等,则从Ⅰ到Ⅱ的过程为固体质量增大的过程,平衡逆向移动,为熵减过程,故从Ⅰ到Ⅱ的过程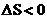 ,A错误;
,A错误;
B.平衡常数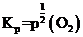 只受温度的影响,则
只受温度的影响,则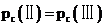 ,B错误;
,B错误;
C.反应为吸热反应,降低温度,平衡逆向移动,平衡常数减小,故平衡常数: ,C正确;
,C正确;
D.已知状态Ⅰ和Ⅲ的固体质量相等,则氧气的物质的量相等,若体积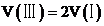 ,根据阿伏伽德罗定律可知,
,根据阿伏伽德罗定律可知,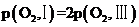 ,
,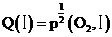 ,
,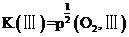 ,则
,则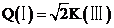 ,D正确;
,D正确;
E.结合A分析可知,逆反应的速率: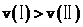 ;固体不影响反应速率,温度越低反应速率越低,逆反应的速率:
;固体不影响反应速率,温度越低反应速率越低,逆反应的速率: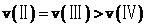 ,故有逆反应的速率:
,故有逆反应的速率: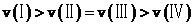 ,E正确;
,E正确;
故选CDE;
③某温度下,设向恒容容器中加入mgAg2O,当固体质量减少4%时,逆反应速率最大,此时达到平衡状态,减小质量为生成氧气的质量,则生成 O2,若转化率为14.5%,则此时生成
O2,若转化率为14.5%,则此时生成 O2,根据阿伏伽德罗定律,此时
O2,根据阿伏伽德罗定律,此时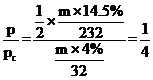 ,故
,故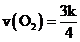 ;
;
【小问3详解】
①晶体与非晶体的最可靠的科学方法是X射线衍射法;故测定晶体结构最常用的仪器是D.X射线衍射仪;
②据“均摊法”,γ-AgI晶胞中含 个I,则晶体密度为
个I,则晶体密度为 ;,α-AgI晶胞中含
;,α-AgI晶胞中含 个I,则晶体密度为
个I,则晶体密度为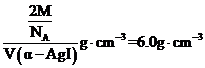 ;故
;故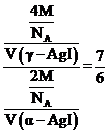 ,则γ-AgI与α-AgI晶胞的体积之比为12:7。
,则γ-AgI与α-AgI晶胞的体积之比为12:7。
③由图可知,a为阳极、b为阴极,实验测得支管a中AgI质量不变,则碘离子没有迁移到a中与银离子产生AgI沉淀,银离子在阴极得到电子发生还原反应生成银单质,导致b中银电极质量增大,a中银电极银单质失去电子发生氧化反应生成银离子,导致a中银电极质量质量减小,可判定导电离子是Ag+而不是I-。
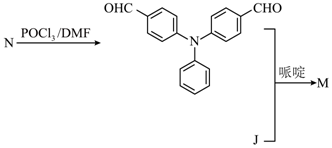
【2023重庆等级考】18. 有机物K作为一种高性能发光材料,广泛用于有机电致发光器件(OLED)。K的一种合成路线如下所示,部分试剂及反应条件省略。
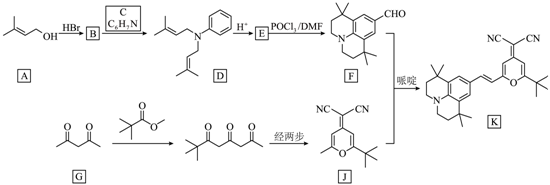
已知: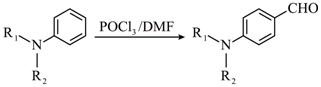 (R1和R2为烃基)
(R1和R2为烃基)
(1)A中所含官能团名称为羟基和_______。
(2)B的结构简式为_______。
(3)C的化学名称为_______,生成D的反应类型为_______。
(4)E的结构简式为_______。
(5)G的同分异构体中,含有两个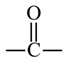 的化合物有_______个(不考虑立体异构体),其中核磁共振氢谱有两组峰,且峰面积比为
的化合物有_______个(不考虑立体异构体),其中核磁共振氢谱有两组峰,且峰面积比为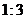 的化合物为L,L与足量新制的Cu(OH)2反应的化学方程式为_______。
的化合物为L,L与足量新制的Cu(OH)2反应的化学方程式为_______。
(6)以J和N(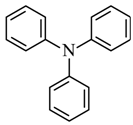 )为原料,利用上述合成路线中的相关试剂,合成另一种用于OLED的发光材料M(分子式为
)为原料,利用上述合成路线中的相关试剂,合成另一种用于OLED的发光材料M(分子式为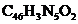 )。制备M的合成路线为_______(路线中原料和目标化合物用相应的字母J、N和M表示)。
)。制备M的合成路线为_______(路线中原料和目标化合物用相应的字母J、N和M表示)。
【答案】(1)碳碳双键
(2) (3) ①. 苯胺 ②.取代反应
(3) ①. 苯胺 ②.取代反应
(4) (5) ①. 9 ②.
C(CH3)2(CHO)2+4Cu(OH)2+2NaOH
(5) ①. 9 ②.
C(CH3)2(CHO)2+4Cu(OH)2+2NaOH C(CH3)2(COONa)2+2Cu2O+6H2O
C(CH3)2(COONa)2+2Cu2O+6H2O
(6)
【解析】
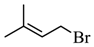
【分析】A和HBr发生取代反应生成B,B是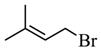 ;B和C生成D,根据B的结构简式和C的分子式,由D逆推可知C是
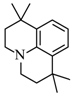
;B和C生成D,根据B的结构简式和C的分子式,由D逆推可知C是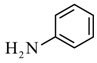 ;根据题目信息,由F逆推可知E是
;根据题目信息,由F逆推可知E是 。
。
【小问1详解】
根据A的结构简式,可知A中所含官能团名称为羟基和碳碳双键;
【小问2详解】
A和HBr发生取代反应生成B,B是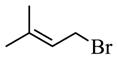 ;
;
【小问3详解】
C是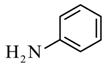 ,化学名称为苯胺;
,化学名称为苯胺; 和
和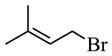 反应生成D和HBr,生成D的反应类型为取代反应;
反应生成D和HBr,生成D的反应类型为取代反应;
【小问4详解】
根据题目信息,由F逆推可知E是 ;
;
【小问5详解】
G的同分异构体中,含有两个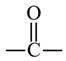 的化合物有
的化合物有 、
、 、
、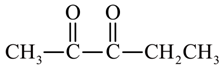 、
、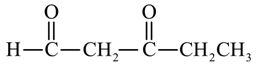 、
、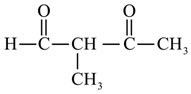 、
、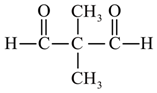 、
、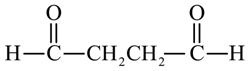 、
、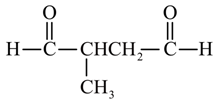 、
、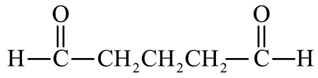 ,共9个(不包括G本身),其中核磁共振氢谱有两组峰,且峰面积比为
,共9个(不包括G本身),其中核磁共振氢谱有两组峰,且峰面积比为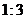 的化合物为L,L是
的化合物为L,L是 ,L与足量新制的
,L与足量新制的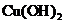 反应的化学方程式为 C(CH3)2(CHO)2+4Cu(OH)2+2NaOH
反应的化学方程式为 C(CH3)2(CHO)2+4Cu(OH)2+2NaOH C(CH3)2(COONa)2+2Cu2O+6H2O。
C(CH3)2(COONa)2+2Cu2O+6H2O。
【小问6详解】
M分子中含有5个N和2个O,可知2分子J和1分子N反应生成M,合成路线为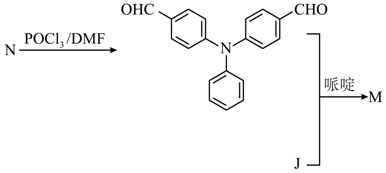 ;
;

- 全部评论(0)