元素周期表及元素周期律问题集
时间:2024-01-16 16:02 来源:未知 作者:Chem哥 点击: 次 所属专题: 元素周期律 元素周期表
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、为什么氧、氟没有最高正价?
氟是非金属性最强的元素,理论上没有哪种物质能将其氧化,因此没有正价(电负性也能解释,F是电负性最强的元素)。
氧的电负性也很强,但是遇到电负性最强的F时,氧可以显正价,如OF2中,F为-1价,氧为+2价。但是氧与氟不能形成OF6,因为氧的价层电子为2s22p4,氧原子只有2个未成对电子,F原子又不能提供空轨道形成配位键,所以氧元素没有+6价。(参考选修三共价键,配位键)
2、铁离子与亚铁离子只差一个电子,为什么颜色不同?
首先,说一说物质的颜色。自然界所有东西都这样的,太阳光照射到该物质上,该物质吸收了一部分光,剩下光的没有吸收,就显示剩下的光的颜色了。如果吸收了红光,那么对应的,他就显示绿色。
离子之所以表现色彩,是因为其允许特定能量的电子跃迁、吸收特定频率的光。用晶体场理论来解释,三价铁二价铁在和H2O的配位场作用下D轨道会裂变,电子在D轨道之间跃迁产生颜色,由于两种水合离子的分裂的能力不同,所以产生的颜色就会不同。亚铁水合离子分裂能小,吸收的光子能量相对较低,应该对应的是红光区,所以看到的是它的互补色,浅绿色;而铁的水合离子分裂能相对稍大,应该对应橙光,所以看到的是它的互补色,浅紫色(不是黄色!)。平时我们看到的黄色是由于三价铁离子水解造成的。(参考大学《无机化学》或《普通化学》配位化合物晶体场理论)
3.为什么每一能层容最多容纳的电子数为2n2?
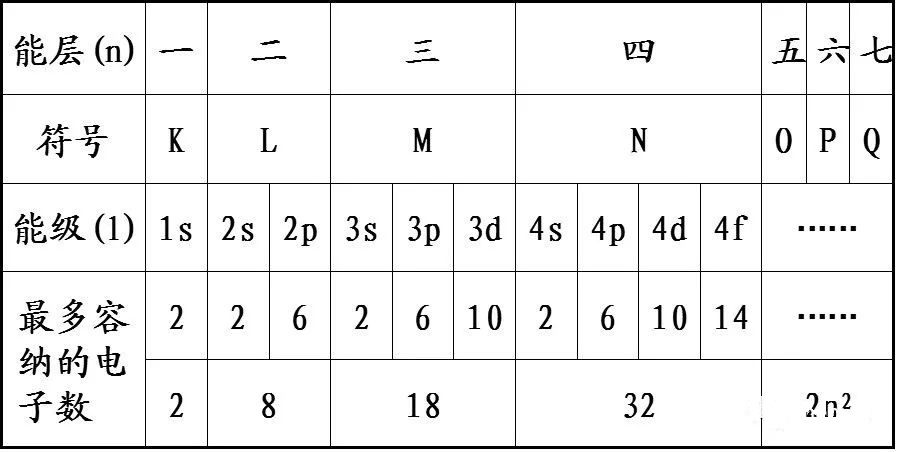
“能层”只是一个比较粗略的概念。
每一能层下还有不同的能级,而每一能级下面又有不同的轨道,电子就填充在这些轨道里面。第一层只有1个轨道;第二层有4个轨道,第三层有9个轨道,第n层有n2个轨道。每个轨道容纳的电子数为2个,所以第n层最多容纳电子数为2n2。(参考选修三原子结构)
4.为什么金属性越强,氢氧化物碱性就越强?
我们用M(OH)n表示碱,M代表金属元素,M的金属性越强,电负性越小,M-O之间的电子对更倾向于O,离子键成分更大,越易电离出OH-。(参考选修三电负性)
5.卤素元素最外层电子数都为7,从F到I为什么得电子能力依次减弱?
原子得电子是由于原子核对电子的吸引。原子核所带的正电荷(核电荷)数越大,原子半径越小,对外层电子的引力就越大。
同主族元素,从上往下,电子层数增大,半径增大,对最外层电子的引力减小。
6.为什么常温下,氟、氯单质为气体,碘单质为固体?
F2、Cl2、Br2、I2均为分子晶体,分子结构相似,相对分子质量越大,范德华力越大,熔沸点越高。(参考选修三分子晶体)
7.为什么卤素单质能与氢气反应?
卤素原子最外层7个电子,氢原子最外层1个电子,均是差1个电子达到稳定结构。因此可以共用一个电子对,形成共价键。(参考必修2化学键,选修3共价键)
8.为什么新制氯水放置一段时间会褪色?
Cl2+H2O HCl+HClO① (可逆反应)
HCl+HClO① (可逆反应)
2HClO=2HCl+O2↑(光照)②(可逆反应)
氯气溶于水涉及以上两个平衡,反应②的次氯酸不断分解,导致反应①平衡不断正向移动,最终反应①基本完全。因此溶液中无氯气,变为无色。(参考选修四化学平衡的移动)
9.金属性和还原性一样吗?
有所区别,首先概念主体不同。
金属性概念的主体是金属元素,指金属元素失电子能力大小,金属性越强,越容易失去电子,当然还原性就越强。还原性概念的主体是物质,是物质失去电子能力的大小。如CO,H2等物质都具有还原性。
10.核聚变为什么会放出巨大能量?
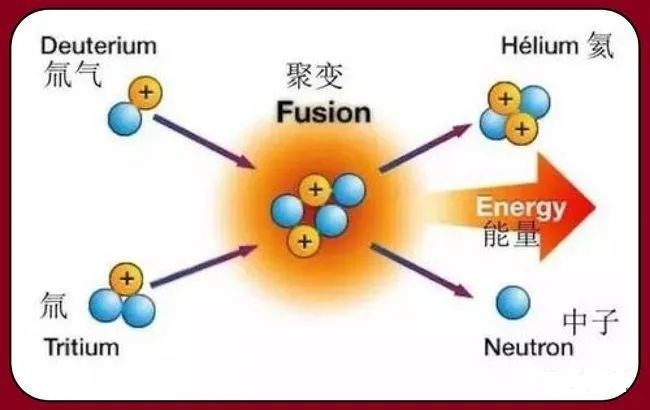
聚变会产生质量亏损,如氢原子聚变后生成的氦原子质量小于之前两个氢原子质量的总和。根据爱因斯坦相对论E=mC2,质量差Δm就会转化成相应的能量。
11.核变是化学变化吗?
不是。核变既原子核发生变化,由于质子数发生了变化,所以元素种类也发生了改变。而化学变化只是核外电子的改变,原子核不变,元素种类是不变的。
12.同周期元素,为什么最外层电子数越多,原子核对最外层电子的引力就越大?
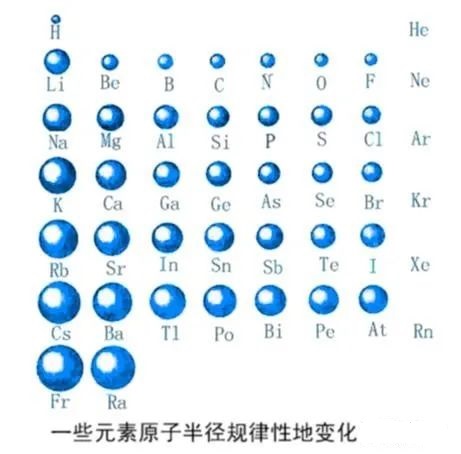
影响半径的因素主要有两点:一是电子层数,另一点是原子核对核外电子的引力。同周期电子层数相同,随着核电荷数的增加,原子核所带的正电荷增加,核外电子受到的引力变大,所以半径减小。
当然,电子的增多,理论上会使原子的半径增大,但是在电子层数不变的情况下,主要考虑核对电子引力的影响。
13.同种元素微粒,为什么电子数越多,半径越大?
当电子层数和核电荷数都一样的情况,电子数越多(也就是最外层电子数越多),电子运动的区域肯定越大,半径就越大。比如Fe2+半径大于Fe3+。
需要注意的是,核电荷数对半径的影响比最外层电子数对半径的影响更大。比如Na和Mg比较半径,虽然Mg的电子数更多,但是核电荷数更大,对外层电子的引力更大,所以镁原子半径更小。
14.碱金属单质的熔沸点为什么从上往下依次降低?
金属晶体含金属键,金属键的键能决定其熔沸点。金属阳离子半径越小,所带核电荷数越大,金属键键能越大,熔沸点越高。碱金属阳离子均带1个单位正电荷,从上往下半径依次增大,金属键键能减小,熔沸点降低。(参考选修三金属晶体)
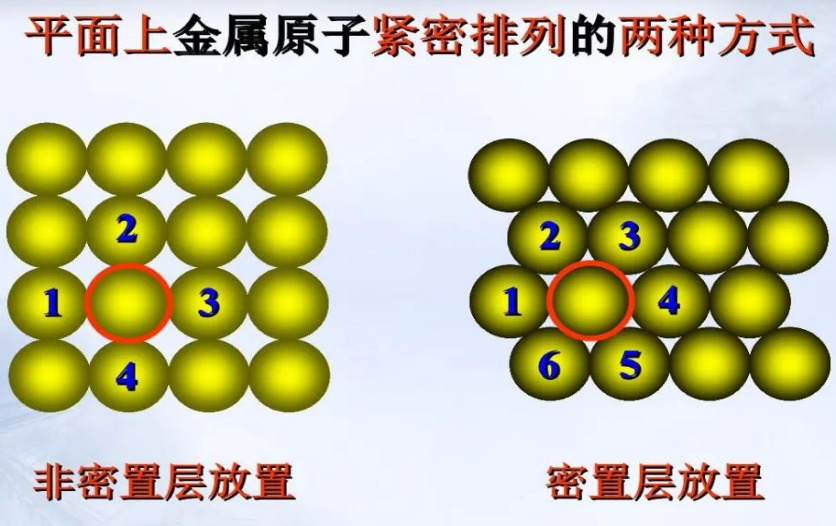
15.相对原子质量越大,金属的密度就越大吗?
不一定。
两个因素影响金属的密度。一是金属原子本身质量,另外是金属原子在空间的堆积方式。如果金属原子在空间堆积方式不是密堆积,空间占有率较低,金属的密度也可能较小。(参考选修三金属晶体堆积方式)
16.只知道2、8、4的电子排列,如何判断是第三周期的ⅣA还是ⅣB?
首先,第三周期没有副族,从第四周期开始才会出现副族。
根据电子排布式可以迅速判断元素在周期表中的位置。(参考选修三电子排布式)
17.非金属性强弱为什么与气态氢化物稳定性有关?
通常,非金属与氢气反应,非金属作氧化剂,氢气作还原剂。非金属性越强,越容易与氢气化合,形成的气态氢化物越稳定,反之也成立。
化学反应遵循这样一个规律:越活泼,越易反应,释放的能量越多,形成的化合物越稳定。感情不就是这样吗?两情相悦,才能天长地久。
18.为什么锡的活动性强于铅,金属性小于铅?
按照金属活动性顺序,Sn>Pb;按照元素周期律,Pb在Sn下面,金属性Pb>Sn。
先说说“金属性”和“金属活动性”这两个概念。高中教材没讨论这个问题,甚至定义都没给,模糊带过,意思就是让同学们不要过于纠结,没特别说明,可以等同。
这两个概念其实有区别。“活动性”是金属单质的性质,可以通过金属与水或酸反应剧烈程度体现出来(可以用更为精确的电极电势数据比较,参考大学无机化学教材)。而“金属性”是元素的原子的性质,是金属原子失去电子变成金属阳离子的倾向,这种倾向的难易与原子结构(半径,电子排布等)密切相关。金属单质与水或酸反应其实质也是失电子,那与元素的原子失电子有何不同呢?首先,金属单质已经是无数的金属原子构成的宏观物质了,金属原子与金属原子的排列方式会影响其性质。其次,金属单质与水或酸反应除了涉及电子的电离,还涉及金属单质的升华能,金属阳离子的水合能等能量变化。所以两者不同,它们的关系有点像个体与整体,不过有时候,“见微”不一定“知著”。
通常,金属元素的金属性越强,其单质的活动性就越强。Sn和Pb是一个特例(其实不止)。最后再说一句,没必要纠结概念,高中可以等同。
19. N的最外层有5个电子,如果得到3个则显-3价,失去5个则显+5价,为什么N还有+1、+2、+3、+4价?
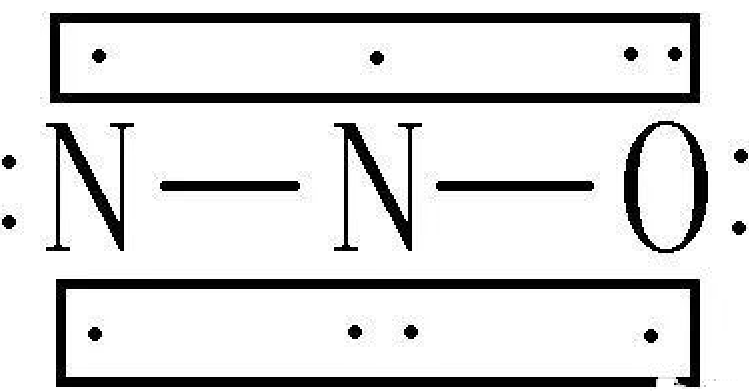
你认为氮元素只能显-3价和+5价是根据8电子(只有1层时2电子)结构来判断的。
元素的成键形式有很多,除了得失电子形成离子键,共用电子形成共价键,还可以通过形成配位键、π键等也可以使分子达到稳定结构,不一定满足8电子结构。
20.镧系和锕系分别属于同周期同族吗?为什么?
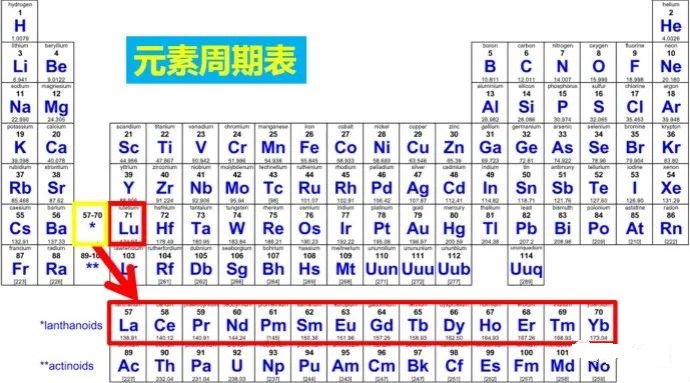
是的。镧系属于第六周期ⅢB,锕系属于第七周期ⅢB。
首先,镧系和锕系都有15种元素,如果展开,一张纸印不了。所以作为同一族单列出来。
其次,元素有一定相似性,除少数特例外,在d轨道上均无电子,最后1个电子电子排布在f轨道上,统一归为ⅢB(其实有点强行的意思)。
21.第8,9,10纵列为什么被划分为同一族?

强行划分。其实某些元素之间差异很大。
周期表中第8,9,10列的9种元素(其实是12种,第七周期的3种人造元素没考虑),它们的水平相似性比垂直相似性更为突出。如第四周期的Fe、Co、Ni它们最外层都只有2个电子,只是次外层3d电子数不同,原子半径又相近,因此性质相似,这三种元素称为铁系元素。剩余六种称为铂系元素。
22.主族和副族是如何划分的?
最 后 1 个电子填入nS或 np亚层上的,是主族元素( 稀有气体除外),其族号数等于原子最外层电子数,最外层电子为其价层电子(决定其化合价)。
最 后 1个电子填入(n - 1 ) d 或 (n - 2 ) f 亚层上的元素属于副族元素,也称为过渡元素,最外层电子和(n - 1 ) d 、 (n - 2 ) f 为其价层电子。(参考选修三电子排布,元素分区)
23.为什么把元素周期表的第3列到12列的元素称为过渡元素?
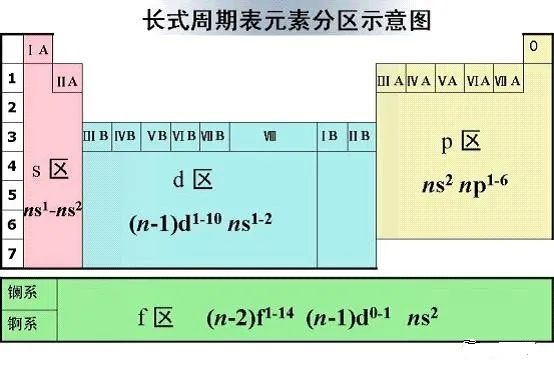
我们把ⅢB族到VⅢ族的化学元素称为过渡元素。由于ns与(n-1)p的能级交错,这些元素原子的最后一个电子并不是填到最外层,而是返回去填充次外层的d能级上,d能级最多容纳10个电子,所以3列到12列共10列。当次外层d能级电子排满后,从13列开始电子才又填充最外层的p能级。所以从第3列到12列,电子的填充在内层“过渡”了一下。过渡元素全为金属,也称为过渡金属。
24.第一张元素周期表就是和现在一样吗?

肯定不是,元素的发现是一个漫长的过程。门捷列夫创建第一张元素周期表时有63种元素。但是,门捷列夫并不是第一个尝试给元素排序的人,早他几十年的道尔顿也为已发现的元素创造过一张表格,但并没流传开来。
25.同位素是什么,化学性质相似吗?元素的相对原子质量与同位素有什么关系?
质子数相同,中子数不同的一类原子。如氢有三种同位素,氕(1H,无中子)、氘(2H,重氢,1个中子)、氚(3H,超重氢,2个中子);碳有三种同位素,12C、13C和 14C(有放射性)等。由于同位素的质子数相同,所以属于同种元素(质子数决定元素种类)。它们的电子排布也完全相同,所以同位素的化学性质也几乎相同。
自然界中存在的某一元素的各种同位素的相对含量(以原子百分计)被称为同位素丰度。如自然界中氢以1H(氕,H),2H(氘,D),3H(氚,T)三种同位素的形式存在,相对丰度分别为约99.9844%、约0.0156%、低于0.001%。氕的相对原子质量为1.007947,氘的相对原子质量为2.274246,氚的相对原子质量为3.023548,元素的相对原子质量是按各种天然同位素原子丰度算出来的加权平均值。所以,虽然重氢和超重氢的相对原子质量比普通氢大,但是由于其丰度太小,利用加权平均数算出来的氢的相对原子质量仍然接近于1。氯元素在自然界中有35Cl、37Cl两种稳定同位素,丰度分别为75.77%和24.23%,相对原子质量分别为34.968 852和36.965 903,因此加权平均数算出氯的相对原子质量约为35.45。
34.969×0.7577+36.966 ×0.2423=35.45
26.我们平常所说的氢元素,没特别说明指的是1H吗?
对。
27.所有元素都有同位素吗?
理论上所有元素的中子数都可以变化,都有同位素,只是是否稳定存在而已。在已知的元素中有大约20种元素没有稳定同位素,但是人工可以制造它们的同位素。
28.如何用碳14测定年代?
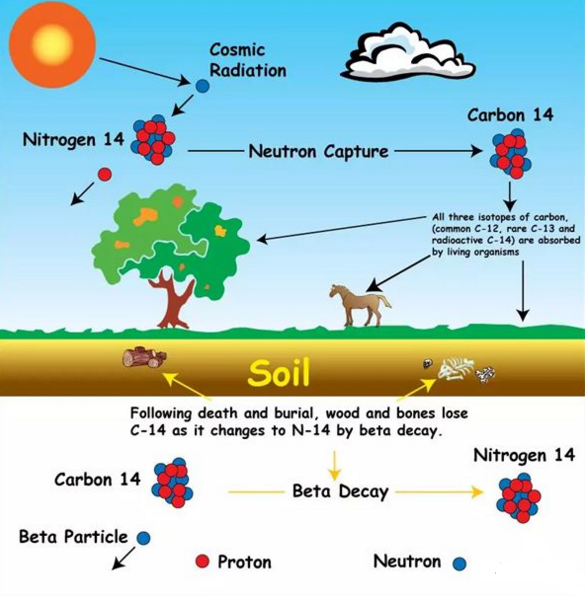
在地球上有99%的碳以碳-12的形式存在,有大约1%的碳以碳-13的形式存在,只有兆分之一(0.0000000001%)是碳-14,存在于大气中,由大气中氮与宇宙射线作用生成,其丰度基本保持不变。
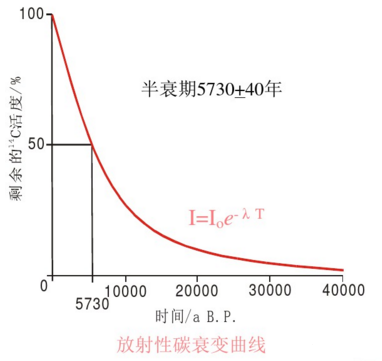
宇宙射线在大气中能够产生放射性碳—14,并能与氧结合成二氧化碳后进入所有活组织,先为植物吸收,后为动物纳入。只要植物或动物生存着,它们就会持续不断地吸收碳—14,在机体内保持一定的水平。而当有机体死亡后,即会停止呼吸碳—14,其组织内的碳—14便以5730年的半衰期开始衰变并逐渐消失。对于任何含碳物质,只要测定剩下的放射性碳—14的含量,就可推断其年代。
29. 如何比较不同周期不同主族元素的原子半径大小?电子层数多的原子半径一定比层数小的原子半径大吗?
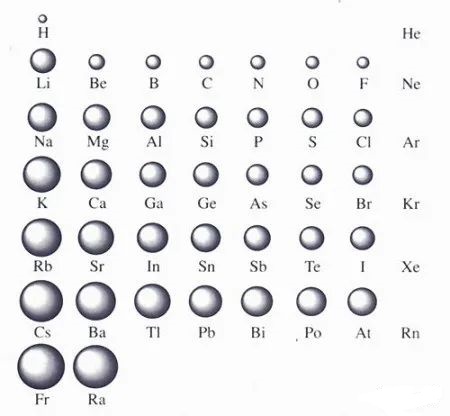
原子半径大小取决于两个因素:1、电子受核的吸引力的大小,这个力有使原子半径缩小的趋势;2、电子与电子之间的排斥力,这个力有和核的库仑引力作用相反的趋势,它使原子半径增大。这两个因素的作用刚刚相反。判断的时候要抓住主次。同周期元素,影响半径的因素主要是前者,所以随着核电荷数的增加,半径减小;同主族,影响半径的因素主要是后者,所以随着核电荷数增多,半径增大。
不同周期不同族的比较没有规律。层数多,由于核电荷数也大,半径不一定就大。比如,第二周期Li原子半径比第三、四、五周期的Cl、Br、I原子的半径都要更大。
30. 铷和铯那么活泼,如何保存?

铷和铯太过活泼,就算保存在液体石蜡中也会被容溶解氧侵蚀,因此一般保存在玻璃封装的安瓿瓶内,真空或充惰性气体保护。
31. Li与氧气反应会生成过氧化锂吗?
不会,锂的还原性不够强,只生成氧化锂Li2O。随着还原性增强,同主族的钠可以生成过氧化钠Na2O2,钾可以生成超氧化钾KO2。

- 全部评论(0)
