2024年河北普通高中学业水平选择性考试
时间:2024-07-02 08:52 来源:未知 作者:化学自习室 点击:次 所属专题: 新高考题库
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、选择题:本题共14小题,每小题3分,共42分。在每小题给出的四个选项中,只有一项是符合题目要求的。
【2024河北等级考】1. 燕赵大地历史悠久,文化灿烂。对下列河北博物院馆藏文物的说法错误的是

A. 青铜铺首主要成分是铜锡合金 B. 透雕白玉璧主要成分是硅酸盐
C. 石质浮雕主要成分是碳酸钙 D. 青花釉里红瓷盖罐主要成分是硫酸钙
【答案】D
【解析】
【详解】A.青铜铺首是青铜器,青铜的主要成分是铜锡合金,A正确;
B.透雕白玉璧是玉石,玉石的主要成分是硅酸盐,B正确;
C.石质浮雕是汉白玉,汉白玉的主要成分是碳酸钙,C正确;
D.青花釉里红瓷盖罐是陶瓷,陶瓷的主要成分是硅酸盐,D错误;
故选D。
【2024河北等级考】2. 关于实验室安全,下列表述错误的是
A. BaSO4等钡的化合物均有毒,相关废弃物应进行无害化处理
B. 观察烧杯中钠与水反应的实验现象时,不能近距离俯视
C. 具有 标识的化学品为易燃类物质,应注意防火
标识的化学品为易燃类物质,应注意防火
D. 硝酸具有腐蚀性和挥发性,使用时应注意防护和通风
【答案】A
【解析】
【详解】A.BaSO4性质稳定,不溶于水和酸,可用作“钡餐”说明对人体无害,无毒性,A错误;
B.钠与水反应剧烈且放热,观察烧杯中钠与水反应的实验现象时,不能近距离俯视,B正确;
C. 为易燃类物质的标识,使用该类化学品时应注意防火,以免发生火灾,C正确;
为易燃类物质的标识,使用该类化学品时应注意防火,以免发生火灾,C正确;
D.硝酸具有腐蚀性和挥发性,使用时应注意防护和通风,D正确;
故选A。
【2024河北等级考】3. 高分子材料在生产、生活中得到广泛应用。下列说法错误的是
A. 线型聚乙烯塑料为长链高分子,受热易软化
B. 聚四氟乙烯由四氟乙烯加聚合成,受热易分解
C. 尼龙66由己二酸和己二胺缩聚合成,强度高、韧性好
D. 聚甲基丙烯酸酯(有机玻璃)由甲基丙烯酸酯加聚合成,透明度高
【答案】B
【解析】
【详解】A.线型聚乙烯塑料具有热塑性,受热易软化,A正确;
B.聚四氟乙烯由四氟乙烯加聚合成,具有一定的热稳定性,受热不易分解,B错误;
C.尼龙66即聚己二酰己二胺,由己二酸和己二胺缩聚合成,强度高、韧性好,C正确;
D.聚甲基丙烯酸酯由甲基丙烯酸酯加聚合成,又名有机玻璃,说明其透明度高,D正确;
故选B
【2024河北等级考】4. 超氧化钾(KO2)可用作潜水或宇航装置的CO2吸收剂和供氧剂,反应为4KO2+2CO2=2K2CO3+3O2,NA为阿伏加德罗常数的值。下列说法正确的是
A. 44g CO2中σ键的数目为2NA
B. 1mol KO2晶体中离子的数目为3NA
C. 1L 1mol/L K2CO3溶液中CO32-的数目为NA
D. 该反应中每转移1mol电子生成O2的数目为1.5NA
【答案】A
【解析】
【详解】A.44g(即1mol)CO2中σ键的数目为2NA,A正确;
B.KO2由K+和O2-构成,1mol KO2晶体中离子的数目为2NA,B错误;
C.CO32-在水溶液中会发生水解:CO32-+H2O HCO3-+OH-,故 1L 1mol/L K2CO3溶液中CO32-的数目小于NA,C错误;
HCO3-+OH-,故 1L 1mol/L K2CO3溶液中CO32-的数目小于NA,C错误;
D.该反应中部分氧元素化合价由-0.5价升至0价,部分氧元素化合价由-0.5价降至-2价,则每4molKO2参加反应转移3mol电子,每转移1mol电子生成O2的数目为NA,D错误;
故选A。
【2024河北等级考】5. 化合物X是由细菌与真菌共培养得到的一种天然产物,结构简式如图。下列相关表述错误的是

A. 可与Br2发生加成反应和取代反应 B. 可与FeCl3溶液发生显色反应
C. 含有4种含氧官能团 D. 存在顺反异构
【答案】D
【解析】
【详解】A.化合物X中存在碳碳双键,能和Br2发生加成反应,苯环连有酚羟基,下方苯环上酚羟基邻位有氢原子,可以与Br2发生取代反应,A正确;
B.化合物X中有酚羟基,遇FeCl3溶液会发生显色反应,B正确;
C.化合物X中含有酚羟基、醛基、酮羰基、醚键4种含氧官能团,C正确;
D.该化合物中只有一个碳碳双键,其中一个双键碳原子连接的2个原子团都是甲基,所以不存在顺反异构,D错误;
故选D。
【2024河北等级考】6. 下列实验操作及现象能得出相应结论的是
选项 | 实验操作及现象 | 结论 |
A | 还原铁粉与水蒸气反应生成的气体点燃后有爆鸣声 | H2O具有还原性 |
B | 待测液中滴加BaCl2溶液,生成白色沉淀 | 待测液含有SO42- |
C | Mg(OH)2和Al(OH)3中均分别加入NaOH溶液和盐酸,Mg(OH)2只溶于盐酸,Al(OH)3都能溶 | Mg(OH)2比Al(OH)3碱性强 |
D | K2Cr2O7溶液中滴加NaOH溶液,溶液由橙色变为黄色 | 增大生成物的浓度,平衡向逆反应方向移动 |
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.铁与水蒸气反应生成的气体是h2,该反应中H由+1价变成0价,被还原,体现了h2o的氧化性,A错误;
B.如果待测液中含有Ag+,Ag+与Cl-反应也能产生白色沉淀,或者cO32-、SO32-也会与Ba2+产生白色沉淀,所以通过该实验不能得出待测液中含有SO42-的结论,B错误;
C.Mg(OH)2溶液能与盐酸反应,不能与NaOH溶液反应,Al(OH)3与NaOH溶液和盐酸都能反应,说明Mg(OH)2的碱性比Al(OH)3的强,C正确;
D.K2Cr2O7溶液中存在平衡Cr2O72-(橙色)+2H2O CrO42-(黄色)+2H+,加入NaOH溶液后,OH-与H+反应,生成物浓度减小,使平衡正向移动,导致溶液由橙色变为黄色,题给结论错误,D错误;
CrO42-(黄色)+2H+,加入NaOH溶液后,OH-与H+反应,生成物浓度减小,使平衡正向移动,导致溶液由橙色变为黄色,题给结论错误,D错误;
故选C。
【2024河北等级考】7. 侯氏制碱法工艺流程中的主反应为QR+YW3+XZ2+W2Z=QWXZ3+YW4R,其中W、X、Y、Z、Q、R分别代表相关化学元素。下列说法正确的是
A. 原子半径:W<X<Y B. 第一电离能:X<Y<Z
C. 单质沸点:Z<R<Q D. 电负性:W<Q<R
【答案】C
【解析】
【分析】侯氏制碱法主反应的化学方程式为NaCl+NH3+CO2+H2O=NaHCO3↓+NH4Cl,则可推出W、X、Y、Z、Q、R分别为H元素、C元素、N元素、O元素、Na元素、Cl元素。
【详解】A.一般原子的电子层数越多半径越大,电子层数相同时,核电荷数越大,半径越小,则原子半径: ,故A错误;
,故A错误;
B.同周期从左到右元素第一电离能呈增大趋势,ⅡA族、ⅤA族原子的第一电离能大于同周期相邻元素,则第一电离能: ,故B错误;
,故B错误;
C.O2、Cl2为分子晶体,相对分子质量越大,沸点越高,二者在常温下均为气体,Na在常温下为固体,则沸点: ,故C正确;
,故C正确;
D.同周期元素,从左往右电负性逐渐增大,同族元素,从上到下电负性逐渐减小,电负性: ,故D错误;
,故D错误;
故选C。
【2024河北等级考】8. 从微观视角探析物质结构及性质是学习化学的有效方法。下列实例与解释不符的是
选项 | 实例 | 解释 |
A | 原子光谱是不连续的线状谱线 | 原子的能级是量子化的 |
B | CO2、CH2O、CH4键角依次减小 | 孤电子对与成键电子对的斥力大于成键电子对之间的斥力 |
C | CsCl晶体中Cs+与8个Cl-配位,而NaCl晶体中Na+与6个Cl-配位 | Cs+比Na+的半径大 |
D | 逐个断开CH4中的C-H键,每步所需能量不同 | 各步中的C-H键所处化学环境不同 |
A. A B. B C. C D. D
【答案】B
【解析】
【详解】A.原子光谱是不连续的线状谱线,说明原子的能级是不连续的,即原子能级是量子化的,故A正确;
B.CO2中心C原子为sp杂化,键角为180,CH2O中心C原子为sp2杂化,键角大约为120,CH4中心C原子为sp3杂化,键角为109°28',三种物质中心C原子都没有孤电子对,三者键角大小与孤电子对无关,故B错误;
C.离子晶体的配位数取决于阴、阳离子半径的相对大小,离子半径比越大,配位数越大,Cs+周围最多能排布8个Cl-,Na+周围最多能排布6个Cl-,说明Cs+比Na+半径大,故C正确;
D.断开第一个键时,碳原子周围的共用电子对多,原子核对共用电子对的吸引力较弱,需要能量较小,断开C-H键越多,碳原子周围共用电子对越少,原子核对共用电子对的吸引力越大,需要的能量变大,所以各步中的C-H键所处化学环境不同,每步所需能量不同,故D正确;
故选B。
【2024河北等级考】9. NH4ClO4是火箭固体燃料重要的氧载体,与某些易燃物作用可全部生成气态产物,如:NH4ClO4+2C=NH3↑+2CO2↑+HCl↑。下列有关化学用语或表述正确的是
A. HCl的形成过程可表示为![]()
B. NH4ClO4中的阴、阳离子有相同的VSEPR模型和空间结构
C. 在C60、石墨、金刚石中,碳原子有sp、sp2和sp3三种杂化方式
D.NH3和CO2都能作制冷剂是因为它们有相同类型的分子间作用力
【答案】B
【解析】
【详解】A.HCl是共价化合物,其电子式为
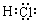 ,HCl的形成过程可表示为
,HCl的形成过程可表示为 ,故A错误;
,故A错误;
B.NH4ClO4中NH4+的中心N原子孤电子对数为 ,价层电子对数为4,ClO4-的中心Cl原子孤电子对数为
,价层电子对数为4,ClO4-的中心Cl原子孤电子对数为 ,价层电子对数为4,则二者的VSEPR模型和空间结构均为正四面体形,故B正确;
,价层电子对数为4,则二者的VSEPR模型和空间结构均为正四面体形,故B正确;
C.C60、石墨、金刚石中碳原子的杂化方式分别为sp、sp2和sp3,共有2种杂化方式,故C错误;
D.NH3易液化,其气化时吸收热量,可作制冷剂,干冰易升华,升华时吸收热量,也可作制冷剂,NH3分子间作用力为氢键和范德华力,CO2分子间仅存在范德华力,故D错误;
故选B。
【2024河北等级考】10. 图示装置不能完成相应气体的发生和收集实验的是(加热、除杂和尾气处理装置任选)

选项 | 气体 | 试剂 |
A | SO2 | 饱和Na2SO3溶液+浓硫酸 |
B | Cl2 | MnO2+浓盐酸 |
C | NH3 | 固体NH4Cl+熟石灰 |
D | CO2 | 石灰石+稀盐酸 |
A. A B. B C. C D. D
【答案】C
【解析】
【分析】如图所示的气体发生装置可以为固液加热型反应,也可以是固液不加热型;右侧气体收集装置,长进短出为向上排空气法,短进长出为向下排空气法,装满水后短进长出为排水法;
【详解】A.饱和Na2SO3溶液和浓硫酸反应可以制SO2,使用固液不加热制气装置,SO2密度比空气大,用向上排空气法收集,可以完成相应气体的发生和收集实验,A不符合题意;
B.MnO2和浓盐酸加热反应可以制Cl2,使用固液加热制气装置,Cl2密度比空气大,用向上排空气法收集,可以完成相应气体的发生和收集实验,B不符合题意;
C.固体NH4Cl与熟石灰加热可以制NH3需要使用固固加热制气装置,图中装置不合理,不能完成相应气体的发生和收集实验,C符合题意;
D.石灰石(主要成分为CaCO3)和稀盐酸反应可以制CO2,使用固液不加热制气装置,CO2密度比空气大,用向上排空气法收集,可以完成相应气体的发生和收集实验,D不符合题意;
本题选C。
【2024河北等级考】11. 在水溶液中,CN-可与多种金属离子形成配离子。X、Y、Z三种金属离子分别与CN-形成配离子达平衡时, 与-lgc(CN-)的关系如图。
与-lgc(CN-)的关系如图。

下列说法正确的是
A. 99%的X、Y转化为配离子时,两溶液中CN-的平衡浓度:X>Y
B. 向Q点X、Z的混合液中加少量可溶性Y盐,达平衡时
C. 由Y和Z分别制备等物质的量的配离子时,消耗CN-的物质的量:Y<Z
D. 若相关离子的浓度关系如P点所示,Y配离子的解离速率小于生成速率
【答案】B
【解析】
【详解】A.99%的X、Y转化为配离子时,溶液中 ,则
,则 ,根据图像可知,纵坐标约为-2时,溶液中
,根据图像可知,纵坐标约为-2时,溶液中 ,则溶液中CN-的平衡浓度:X<Y,A错误;
,则溶液中CN-的平衡浓度:X<Y,A错误;
B.Q点时 ,即
,即 ,加入少量可溶性Y盐后,会消耗CN-形成Y配离子,使得溶液中c(CN-)减小(沿横坐标轴向右移动),
,加入少量可溶性Y盐后,会消耗CN-形成Y配离子,使得溶液中c(CN-)减小(沿横坐标轴向右移动), 与
与 曲线在Q点相交后,随着-lgc(CN-)继续增大,X对应曲线位于Z对应曲线上方,即
曲线在Q点相交后,随着-lgc(CN-)继续增大,X对应曲线位于Z对应曲线上方,即 ,则
,则 ,B正确;
,B正确;
C.设金属离子形成配离子的离子方程式为金属离子+mCN-=配离子,则平衡常数 ,
, ,即
,即 ,故X、Y、Z三种金属离子形成配离子时结合的CN-越多,对应
,故X、Y、Z三种金属离子形成配离子时结合的CN-越多,对应 曲线斜率越大,由题图知,曲线斜率:Y>Z,则由Y、Z制备等物质的量的配离子时,消耗CN-的物质的量:Z<Y,C错误;
曲线斜率越大,由题图知,曲线斜率:Y>Z,则由Y、Z制备等物质的量的配离子时,消耗CN-的物质的量:Z<Y,C错误;
D.由P点状态移动到形成Y配离子的反应的平衡状态时,-lgc(CN-)不变, 增大,即c(Y)增大、c(Y配离子)减小,则P点状态Y配离子的解离速率>生成速率,D错误;
增大,即c(Y)增大、c(Y配离子)减小,则P点状态Y配离子的解离速率>生成速率,D错误;
本题选B。
【2024河北等级考】12. 金属铋及其化合物广泛应用于电子设备、医药等领域。如图是铋的一种氟化物的立方晶胞及晶胞中MNPQ点的截面图,晶胞的边长为a pm,NA为阿伏加德罗常数的值。下列说法错误的是

A. 该铋氟化物的化学式为BiF3
B. 粒子S、T之间的距离为
C. 该晶体的密度为
D. 晶体中与铋离子最近且等距的氟离子有6个
【答案】D
【解析】
【详解】A.根据题给晶胞结构,由均摊法可知,每个晶胞中含有 个Bi3+,含有
个Bi3+,含有 个F-,故该铋氟化物的化学式为BiF3,故A正确;
个F-,故该铋氟化物的化学式为BiF3,故A正确;
B.将晶胞均分为8个小立方体,由晶胞中MNPQ点的截面图可知,晶胞体内的8个F-位于8个小立方体的体心,以M为原点建立坐标系,令N的原子分数坐标为(0,0,1),与Q、M均在同一条棱上的F-的原子分数坐标为(1,0,0),则T的原子分数坐标为 , S的原子分数坐标为
, S的原子分数坐标为 ,所以粒子S、T之间的距离为
,所以粒子S、T之间的距离为 ,故B正确;
,故B正确;
C.由A项分析可知,每个晶胞中有4个Bi3+、12个F-,晶胞体积为 ,则晶体密度为
,则晶体密度为 =
= ,故C正确;
,故C正确;
D.以晶胞体心处铋离子为分析对象,距离其最近且等距的氟离子位于晶胞体内,为将晶胞均分为8个小立方体后,每个小立方体的体心的F-,即有8个,故D错误;
故答案为:D。
【2024河北等级考】13. 我国科技工作者设计了如图所示的可充电Mg-CO2电池,以Mg(TFSI)2为电解质,电解液中加入1,3-丙二胺(PDA)以捕获CO2,使放电时CO2还原产物为MgC2O4。该设计克服了MgCO3导电性差和释放CO2能力差的障碍,同时改善了Mg2+的溶剂化环境,提高了电池充放电循环性能。

下列说法错误的是
A. 放电时,电池总反应为2CO2+Mg=MgC2O4
B. 充电时,多孔碳纳米管电极与电源正极连接
C. 充电时,电子由Mg电极流向阳极,Mg2+向阴极迁移
D. 放电时,每转移1mol电子,理论上可转化1molCO2
【答案】C
【解析】
【分析】放电时CO2转化为MgC2O4,碳元素化合价由+4价降低为+3价,发生还原反应,所以放电时,多孔碳纳米管电极为正极、Mg电极为负极,则充电时多孔碳纳米管电极为阳极、Mg电极为阴极。
【详解】A.根据以上分析,放电时正极反应式为2CO2+Mg2++2e-=MgC2O4、负极反应式为Mg-2e-=Mg2+,将放电时正、负电极反应式相加,可得放电时电池总反应:2CO2+Mg=MgC2O4,故A正确;B.充电时,多孔碳纳米管电极上发生失电子的氧化反应,则多孔碳纳米管在充电时是阳极,与电源正极连接,故B正确;
C.充电时,Mg电极为阴极,电子从电源负极经外电路流向Mg电极,同时Mg2+向阴极迁移,故C错误;
D.根据放电时的电极反应式2CO2+Mg2++2e-=MgC2O4可知,每转移2mol电子,有2molCO2参与反应,因此每转移1mol电子,理论上可转化1molCO2,故D正确;
故答案为:C。
【2024河北等级考】14. 我国科技工作者设计了如图所示的可充电Mg-CO2电池,以Mg(TFSI)2为电解质,电解液中加入1,3-丙二胺(PDA)以捕获CO2,使放电时CO2还原产物为MgC2O4。该设计克服了MgCO3导电性差和释放CO2能力差的障碍,同时改善了Mg2+的溶剂化环境,提高了电池充放电循环性能。

对上述电池放电时CO2的捕获和转化过程开展了进一步研究,电极上CO2转化的三种可能反应路径及相对能量变化如图(*表示吸附态)。

下列说法错误的是
A.PDA捕获CO2的反应为
B. 路径2是优先路径,速控步骤反应式为
C. 路径1、3经历不同的反应步骤但产物相同;路径2、3起始物相同但产物不同
D. 三个路径速控步骤均涉及 转化,路径2、3的速控步骤均伴有PDA再生
转化,路径2、3的速控步骤均伴有PDA再生
【答案】D
【解析】
【详解】A.根据题给反应路径图可知,PDA(1,3-丙二胺)捕获CO2的产物为 ,因此PDA捕获CO2的反应为
,因此PDA捕获CO2的反应为 ,故A正确;
,故A正确;
B.由反应进程-相对能量图可知,路径2的最大能垒最小,因此与路径1和路径3相比,路径2是优先路径,且路径2的最大能垒为 的步骤,据反应路径2的图示可知,该步骤有
的步骤,据反应路径2的图示可知,该步骤有 参与反应,因此速控步骤反应式为
参与反应,因此速控步骤反应式为
 ,故B正确;
,故B正确;
C.根据反应路径图可知,路径1、3的中间产物不同,即经历了不同的反应步骤,但产物均为 ,而路径2、3的起始物均为
,而路径2、3的起始物均为 ,产物分别为
,产物分别为 和
和 ,故C正确;
,故C正确;
D.根据反应路径与相对能量的图像可知,三个路径的速控步骤中 都参与了反应,且由B项分析可知,路径2的速控步骤伴有.PDA再生,但路径3的速控步骤为
都参与了反应,且由B项分析可知,路径2的速控步骤伴有.PDA再生,但路径3的速控步骤为 得电子转化为
得电子转化为 和
和 ,没有PDA的生成,故D错误;
,没有PDA的生成,故D错误;
故答案为:D。
二、非选择题:共58分。
【2024河北等级考】15. 市售的溴(纯度99%)中含有少量的Cl2和I2,某化学兴趣小组利用氧化还原反应原理,设计实验制备高纯度的溴。回答下列问题:
(1)装置如图(夹持装置等略),将市售的溴滴入盛有浓CaBr2溶液的B中,水浴加热至不再有红棕色液体馏出。仪器C的名称为_______;CaBr2溶液的作用为_______;D中发生的主要反应的化学方程式为_______。

(2)将D中溶液转移至_______(填仪器名称)中,边加热边向其中滴加酸化的KMnO4溶液至出现红棕色气体,继续加热将溶液蒸干得固体R。该过程中生成I2的离子方程式为_______。
(3)利用图示相同装置,将R和K2Cr2O7固体混合均匀放入B中,D中加入冷的蒸馏水。由A向B中滴加适量浓H2SO4,水浴加热蒸馏。然后将D中的液体分液、干燥、蒸馏,得到高纯度的溴。D中蒸馏水的作用为_______和_______。
(4)为保证溴的纯度,步骤(3)中K2Cr2O7固体的用量按理论所需量的 计算,若固体R质量为m克(以KBr计),则需称取_______g K2Cr2O7 (M=294g/mol)(用含m的代数式表示)。
计算,若固体R质量为m克(以KBr计),则需称取_______g K2Cr2O7 (M=294g/mol)(用含m的代数式表示)。
(5)本实验所用钾盐试剂均经重结晶的方法纯化。其中趁热过滤的具体操作为漏斗下端管口紧靠烧杯内壁,转移溶液时用_______,滤液沿烧杯壁流下。
【答案】(1) ①. 直形冷凝管 ②. 除去市售的溴中少量的Cl2 ③.Br2+K2C2O4 2KBr+2CO2↑
2KBr+2CO2↑
(2) ①. 蒸发皿 ②.2MnO4-+10I-+16H+ 2Mn2++5I2+8H2O
2Mn2++5I2+8H2O
(3) ①. 液封 ②. 降低温度
(4)0.31m
(5)玻璃棒引流,玻璃棒下端靠在三层滤纸处
【解析】
【分析】市售的溴(纯度99%)中含有少量的Cl2和I2,实验利用氧化还原反应原理制备高纯度的溴,市售的溴滴入盛有浓CaBr2溶液中,Cl2可与CaBr2发生氧化还原反应而除去,I2与Br2一起蒸馏入草酸钾溶液中,并被草酸钾还原为I-、Br-,并向溶液中滴加高锰酸钾溶液氧化I-,加热蒸干得KBr固体,将KBr固体和K2Cr2O7固体混合均匀加入冷的蒸馏水,同时滴加适量浓H2SO4,水浴加热蒸馏,得到的液体分液、干燥、蒸馏,可得高纯度的溴。
【小问1详解】
仪器C为直形冷凝管,用于冷凝蒸气;市售的溴中含有少量的Cl2,Cl2可与CaBr2发生氧化还原反应而除去;水浴加热时,Br2、I2蒸发进入装置D中,分别与K2C2O4发生氧化还原反应,Br2+K2C2O4 2KBr+2CO2↑、I2+K2C2O4
2KBr+2CO2↑、I2+K2C2O4 2KI+2CO2↑,由于Br2为进入D的主要物质,故主要反应的化学方程式为Br2+K2C2O4
2KI+2CO2↑,由于Br2为进入D的主要物质,故主要反应的化学方程式为Br2+K2C2O4 2KBr+2CO2↑ ;
2KBr+2CO2↑ ;
【小问2详解】
将D中溶液转移至蒸发皿中,边加热边向其中滴加酸化的KMnO4溶液至出现红棕色气体(Br2),即说明KMnO4已将KI全部氧化,发生反应的离子方程式为2MnO4-+10I-+16H+ 2Mn2++5I2+8H2O;KBr几乎未被氧化,继续加热将溶液蒸干所得固体R的主要成分为KBr;
2Mn2++5I2+8H2O;KBr几乎未被氧化,继续加热将溶液蒸干所得固体R的主要成分为KBr;
【小问3详解】
密度Br2>H2O,D中冷的蒸馏水起到液封的作用,同时冷的蒸馏水温度较低,均可减少溴的挥发;
【小问4详解】
m克KBr固体的物质的量为 ,根据转移电子相等可得关系式6KBr~6e-~K2Cr2O7,则理论上需要K2Cr2O7的物质的量为
,根据转移电子相等可得关系式6KBr~6e-~K2Cr2O7,则理论上需要K2Cr2O7的物质的量为 ,实际所需称取K2Cr2O7的质量为
,实际所需称取K2Cr2O7的质量为 ;
;
【小问5详解】
趁热过滤的具体操作:漏斗下端管口紧靠烧杯内壁,转移溶液时用玻璃棒引流,玻璃棒下端靠在三层滤纸处,滤液沿烧杯壁流下。
【2024河北等级考】16. V2O5是制造钒铁合金、金属钒的原料,也是重要的催化剂。以苛化泥为焙烧添加剂从石煤中提取V2O5的工艺,具有钒回收率高、副产物可回收和不产生气体污染物等优点。工艺流程如下。

已知:i石煤是一种含V2O3的矿物,杂质为大量Al2O3和少量CaO等;苛化泥的主要成分为CaCO3、NaOH、Na2CO3等。
ⅱ高温下,苛化泥的主要成分可与Al2O3反应生成偏铝酸盐;室温下,偏钒酸钙[Ca(VO3)2]和偏铝酸钙均难溶于水。回答下列问题:
(1)钒原子的价层电子排布式为_______;焙烧生成的偏钒酸盐中钒的化合价为_______,产生的气体①为_______(填化学式)。
(2)水浸工序得到滤渣①和滤液,滤渣①中含钒成分为偏钒酸钙,滤液中杂质的主要成分为_______(填化学式)。
(3)在弱碱性环境下,偏钒酸钙经盐浸生成碳酸钙发生反应的离子方程式为_______;CO2加压导入盐浸工序可提高浸出率的原因为_______;浸取后低浓度的滤液①进入_______(填工序名称),可实现钒元素的充分利用。
(4)洗脱工序中洗脱液的主要成分为_______(填化学式)。
(5)下列不利于沉钒过程的两种操作为_______(填序号)。
a.延长沉钒时间 b.将溶液调至碱性 c.搅拌 d.降低NH4Cl溶液的浓度
【答案】(1) ①.3d34s2 ②. +5 ③. CO2
(2)NaAlO2
(3) ①.  ②. 提高溶液中HCO3-浓度,促使偏钒酸钙转化为碳酸钙,释放VO3- ③. 离子交换
②. 提高溶液中HCO3-浓度,促使偏钒酸钙转化为碳酸钙,释放VO3- ③. 离子交换
(4)NaCl
(5)bd
【解析】
【分析】石煤和苛化泥通入空气进行焙烧,反应生成NaVO3、Ca(VO3)2、NaAlO2、Ca(AlO2)2、CaO和CO2等,水浸可分离焙烧后的可溶性物质(如NaVO3)和不溶性物质[Ca(VO3)2、Ca(AlO2)2等],过滤后滤液进行离子交换、洗脱,用于富集和提纯VO3-,加入氯化铵溶液沉钒,生成NH4VO3,经一系列处理后得到V2O3;滤渣①在pH≈8,65~70℃的条件下加入3%NH4HCO3溶液进行盐浸,滤渣①中含有钒元素,通过盐浸,使滤渣①中的钒元素进入滤液①中,再将滤液①回流到离子交换工序,进行VO3-的富集。
【小问1详解】
钒是23号元素,其价层电子排布式为3d34s2 ;焙烧过程中,氧气被还原,V2O3被氧化生成VO3-,偏钒酸盐中钒的化合价为+5价;CaCO3在800℃以上开始分解,生成的气体①为CO2。
【小问2详解】
由已知信息可知,高温下,苛化泥的主要成分与Al2O3反应生成偏铝酸钠和偏铝酸钙,偏铝酸钠溶于水,偏铝酸钙难溶于水,所以滤液中杂质的主要成分是NaAlO2。
【小问3详解】
在弱碱性环境下,Ca(VO3)2与HCO3-和OH-反应生成CaCO3、VO3-和H2O,离子方程式为: ; CO2加压导入盐浸工序可提高浸出率,因为C可提高溶液中HCO3-浓度,促使偏钒酸钙转化为碳酸钙,释放VO3-;滤液①中含有VO3-、NH4+等,且浓度较低,若要利用其中的钒元素,需要通过离子交换进行分离、富集,故滤液①应进入离子交换工序。
; CO2加压导入盐浸工序可提高浸出率,因为C可提高溶液中HCO3-浓度,促使偏钒酸钙转化为碳酸钙,释放VO3-;滤液①中含有VO3-、NH4+等,且浓度较低,若要利用其中的钒元素,需要通过离子交换进行分离、富集,故滤液①应进入离子交换工序。
【小问4详解】
由离子交换工序中树脂的组成可知,洗脱液中应含有Cl-,考虑到水浸所得溶液中含有Na+,为避免引人其他杂质离子,且NaCl廉价易得,故洗脱液的主要成分应为NaCl。
【小问5详解】
a.延长沉钒时间,能使反应更加完全,有利于沉钒,a不符合题意;
b.NH4Cl呈弱酸性,如果将溶液调至碱性,OH-与NH4+反应,不利于生成NH4VO3,b符合题意;
c.搅拌能使反应物更好的接触,提高反应速率,使反应更加充分,有利于沉钒,c不符合题意;
d.降低NH4Cl溶液的浓度,不利于生成NH4VO3,d符合题意;
故选bd。
【2024河北等级考】17. 氯气是一种重要的基础化工原料,广泛应用于含氯化工产品的生产。硫酰氯及1,4-二(氯甲基)苯等可通过氯化反应制备。
(1)硫酰氯常用作氯化剂和氯磺化剂,工业上制备原理如下:SO2(g)+Cl2(g) SO2Cl2(g) ΔH=-67.59kJ/mol。
SO2Cl2(g) ΔH=-67.59kJ/mol。
①若正反应的活化能为E正kJ/mol,则逆反应的活化能E逆=_______kJ/mol(用含E正的代数式表示)。
②恒容密闭容器中按不同进料比充入SO2(g)和其Cl2(g),测定T1、T2、T3温度下体系达平衡时的Δp(Δp=P0-p,P0为体系初始压强,P0=240Kpa,P为体系平衡压强),结果如图。

上图中温度由高到低的顺序为_______,判断依据为_______。M点Cl2的转化率为_______,T1温度下用分压表示的平衡常数Kp=_______KPa-1。
③下图曲线中能准确表示T1温度下Δp随进料比变化的是_______(填序号)。

(2)1,4-二(氯甲基)苯(D)是有机合成中的重要中间体,可由对二甲苯(X)的氯化反应合成。对二甲苯浅度氯化时反应过程为

以上各反应的速率方程均可表示为ν=Kc(A)c(B),其中c(A)、c(B)分别为各反应中对应反应物的浓度,k为速率常数(K1~K5分别对应反应①~⑤)。某温度下,反应器中加入一定量的X,保持体系中氯气浓度恒定(反应体系体积变化忽略不计),测定不同时刻相关物质的浓度。已知该温度下,K1:K2:K3:K4:K5=100:21:7:4:23。
①30min时,c(X)=6.80mol/L,且30~60min内ν(X)=0.042mol·L-1·min-1,反应进行到60min时,c(X)=_______mol/L。
②60min时,c(D)=0.099mol/L,若0~60min产物T的含量可忽略不计,则此时c(G)=_______mol/L。60min后,随T的含量增加, _______(填“增大”“减小”或“不变”)。
_______(填“增大”“减小”或“不变”)。
【答案】(1) ①.E正+67.59 ②. T3>T2>T1 ③. 该反应正反应放热,且气体分子数减小,反应正向进行时,容器内压强减小,从T3到T1平衡时Δp增大,说明反应正向进行程度逐渐增大,对应温度逐渐降低 ④. 75% ⑤. 0.03 ⑥. D
(2) ①. 5.54 ②. 0.033 ③. 增大
【解析】
【小问1详解】
①根据反应热ΔH与活化能E正和E逆关系为ΔH=正反应活化能-逆反应活化能可知,该反应的 。
。
②该反应的正反应为气体体积减小的反应,因此反应正向进行程度越大,平衡时容器内压强越小,Δp即越大。从T3到T1,Δp增大,说明反应正向进行程度逐渐增大,已知正反应为放热反应,则温度由T3到T1逐渐降低,即T3>T2>T1。由题图甲中M点可知,进料比为n(SO2):n(Cl2)=2,平衡时Δp=60Kpa,已知恒温恒容情况下,容器内气体物质的量之比等于压强之比,可据此列出“三段式”。

可计算得 ,
, 。
。
③由题图甲中M点可知,进料比为2时,Δp=60KPa,结合“三段式”,以及T1时化学平衡常数可知,进料比为0.5时,Δp也为60KPa,曲线D上存在(0.5,60)。本题也可以快解:根据“等效平衡”原理,该反应中SO2和Cl2的化学计量数之比为1:1,则SO2和Cl2的进料比互为倒数(如2与0.5)时,Δp相等。
【小问2详解】
①根据化学反应速率的计算公式时, ,60min时,
,60min时, 。
。
②已知 ,又由题给反应速率方程推知,
,又由题给反应速率方程推知, ,则
,则 ,即60min后c(G)=0.033mol/L。60min后,D和G转化为T的速率比为
,即60min后c(G)=0.033mol/L。60min后,D和G转化为T的速率比为 ,G消耗得更快,则
,G消耗得更快,则 增大。
增大。
【2024河北等级考】18. 甲磺司特(M)是一种在临床上治疗支气管哮喘、特应性皮炎和过敏性鼻炎等疾病的药物。M的一种合成路线如下(部分试剂和条件省略)。

回答下列问题:
(1)A的化学名称为_______。
(2)B→C的反应类型为_______。
(3)D的结构简式为_______。
(4)由F生成G的化学方程式为_______。
(5)G和H相比,H的熔、沸点更高,原因为_______。
(6)K与E反应生成L,新构筑官能团的名称为_______。
(7)同时满足下列条件的I的同分异构体共有_______种。
(a)核磁共振氢谱显示为4组峰,且峰面积比为3:2:2:2;
(b)红外光谱中存在C=O和硝基苯基( )吸收峰。
)吸收峰。
其中,可以通过水解反应得到化合物H的同分异构体的结构简式为_______。
【答案】(1)丙烯酸 (2)加成反应
(3) (4)
(4) +HO-NO2
+HO-NO2
 +H2O
+H2O
(5)H分子中存在羟基,能形成分子间氢键
(6)酰胺基 (7) ①. 6 ②. 
【解析】
【分析】由流程图可知,A与甲醇发生酯化反应生成B,则A的结构简式为 ;B与CH3SH发生加成反应生成C;C在碱性条件下发生酯的水解反应,酸化后生成D,则D的结构简式为
;B与CH3SH发生加成反应生成C;C在碱性条件下发生酯的水解反应,酸化后生成D,则D的结构简式为 ;D与SOCl2发生取代反应生成E;由F的分子式可知,F的结构简式为
;D与SOCl2发生取代反应生成E;由F的分子式可知,F的结构简式为 ;F发生硝化反应生成G,G的结构简式为
;F发生硝化反应生成G,G的结构简式为 ;G在一定条件下发生水解反应生成H,H的结构简式为
;G在一定条件下发生水解反应生成H,H的结构简式为 ;H与
;H与 发生取代反应生成I;I与乙醇钠发生反应生成J;J发生硝基的还原生成K,K的结构简式为
发生取代反应生成I;I与乙醇钠发生反应生成J;J发生硝基的还原生成K,K的结构简式为 ;K与E发生取代反应生成L;L与
;K与E发生取代反应生成L;L与 反应生成M。
反应生成M。
【小问1详解】
由A→B的反应条件和B的结构简式可知该步骤为酯化反应,因此A为 ,其名称为丙烯酸。
,其名称为丙烯酸。
【小问2详解】
B与CH3SH发生加成反应,-H和CH3S-分别加到双键碳原子上生成C。
【小问3详解】
结合C和E的结构简式以及C→D和D→E的反应条件,可知C→D为C先在碱性条件下发生水解反应后酸化,D为 ,D与亚硫酰氯发生取代反应生成E。
,D与亚硫酰氯发生取代反应生成E。
【小问4详解】
F→G的反应中,结合I的结构可知,苯环上碳氯键的对位引入硝基,浓硫酸作催化剂和吸水剂,吸收反应产物中的水,硝化反应的条件为加热,反应的化学方程式是: +HO-NO2
+HO-NO2
 +H2O。
+H2O。
【小问5详解】
由分析可知,G的结构简式为 ,H的结构简式为
,H的结构简式为 ,H分子中存在羟基,能形成分子间氢键,G分子不能形成分子间氢键,分子间氢键会使物质的熔、沸点显著升高。
,H分子中存在羟基,能形成分子间氢键,G分子不能形成分子间氢键,分子间氢键会使物质的熔、沸点显著升高。
【小问6详解】
根据分析可知,K与E反应生成L为取代反应,反应中新构筑的官能团为酰胺基。
【小问7详解】
I的分子式为C9H9NO4,其不饱和度为6,其中苯环占4个不饱和度,C=O和硝基各占1个不饱和度,因此满足条件的同分异构体中除了苯环、C=O和硝基之外没有其他不饱和结构。由题给信息,结构中存在“ ”,根据核磁共振氢谱中峰面积之比为3:2:2:2可知,结构中不存在羟基、存在甲基,结构高度对称,硝基苯基和C=O共占用3个O原子,还剩余1个O原子,因此剩余的O原子只能插入两个相邻的C原子之间。不考虑该O原子,碳骨架的异构有2种,且每种都有3个位置可以插入该O原子,如图:
”,根据核磁共振氢谱中峰面积之比为3:2:2:2可知,结构中不存在羟基、存在甲基,结构高度对称,硝基苯基和C=O共占用3个O原子,还剩余1个O原子,因此剩余的O原子只能插入两个相邻的C原子之间。不考虑该O原子,碳骨架的异构有2种,且每种都有3个位置可以插入该O原子,如图: ,
, (序号表示插入O原子的位置),因此符合题意的同分异构体共有6种。其中,能够水解生成H(
(序号表示插入O原子的位置),因此符合题意的同分异构体共有6种。其中,能够水解生成H( )的结构为
)的结构为 。
。
【点睛】第(7)问在确定同分异构体数量时也可以采用排列法,首先确定分子整体没有支链,且甲基和硝基苯基位于分子链的两端,之后可以确定中间的基团有亚甲基、C=O和氧原子,三者共有 种排列方式,则符合条件的同分异构体共有6种。
种排列方式,则符合条件的同分异构体共有6种。

- 全部评论(0)
