原电池高考考点透视
时间:2016-02-04 13:55 来源: 作者:刘艳香 点击: 次 所属专题: 原电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.确定金属活动性顺序
例1.(1993年上海高考化学题)有A、B、C、D四种金属,将A与B用导线联结起来,浸入电解质溶液中,B不易被腐蚀;将A、D分别投入到等浓度的盐酸中,D比A反应剧烈;将铜浸入b的盐溶液中无明显变化;将铜浸入C的盐溶液中,有金属C析出。据此可推知它们的金属活动性由强到弱的顺序为 ( )
A.D>C>A>B B.D>A>B>C C.D>B>A>C D.B>A>D>C
解析:根据原电池原理,较活泼金属作负极,较不活泼金属作正极,B不易被腐蚀,说明B为正极,金属活动性A>B。另可比较出金属活动性D>A,B>C。故答案为B项。
2.比较反应速率
例2.(2000年北京春季高考化学题)100mL浓度为2 mol·L-1的盐酸跟过量的锌片反应,为加快反应速率,又不影响生成氢气的总量,可采用的方法是( )
A.加入适量的6mol·L-1的盐酸
B.加入数滴氯化铜溶液
C.加入适量蒸馏水
D.加入适量的氯化钠溶液
解析:向溶液中再加入盐酸,H+的物质的量增加,生成H2的总量也增加,A错。加入氯化铜后,锌置换出的少量铜附在锌片上,形成了原电池反应,反应速率加快,又锌是过量的,生成H2的总量决定于盐酸的量,故B正确。向原溶液中加入水或氯化钠溶液都引起溶液中H+浓度的下降,反应速率变慢,故C、D都不正确。本题答案为B项。
3.书写电极反应式、总反应式
例3.(2000年全国高考理综题)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为阳极燃气,空气与CO2的混合气体为阴极助燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
阳极反应式:2CO+2CO32--4e-== 4CO2
阴极反应式:_________________,
电池总反应式:_______________。
解析:作为燃料电池,总的效果就是把燃料进行燃烧。本题中CO为还原剂,空气中O2为氧化剂,电池总反应式为:2CO+O2==2CO2。用总反应式减去电池负极(即题目指的阳极)反应式,就可得到电池正极(即题目指的阴极)反应式:O2+2CO2+4e-== 2CO32- 。
4.分析电极反应
例4.(1999年全国高考化学题)氢镍电池是近年开发出来的可充电电池,它可以取代会产生污染的铜镍电池。氢镍电池的总反应式是:(1/2)H2+NiO(OH)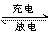 Ni(OH)2
Ni(OH)2
根据此反应式判断下列叙述中正确的是( )
A.电池放电时,电池负极周围溶液的pH不断增大
B.电池放电时,镍元素被氧化
C.电池充电时,氢元素被还原
D.电池放电时,H2是负极
解析:电池的充、放电互为相反的过程,放电时是原电池反应,充电时是电解池反应。根据氢镍电池放电时的总反应式可知,电解质溶液只能是强碱性溶液,不能是强酸性溶液,因为在强酸性溶液中NiO(OH)和Ni(OH)2都会溶解。这样可写出负极反应式:H2+2OH--2e- == 2H2O,H2为负极,附近的pH应下降。放电时镍元素由+3价变为+2价,被还原,充电时氢元素由+1价变为0价,被还原。故答案为C、D项。
例5.(2000年全国高考理综题)钢铁发生电化学腐蚀时,负极发生的反应( )
A.2H++2e-==H2 B.2H2O+O2+4e-== 4OH-
C.Fe-2e-==Fe2+ D.4OH-+4e-==2H2O+O2
解析:钢铁在潮湿的空气中发生电化学腐蚀时,负极为铁,正极为碳,电解质溶液为溶有O2或CO2等气体的水膜。当水膜呈弱酸性或中性时发生吸氧腐蚀,负极反应为:Fe-2e-==Fe2+,正极反应为:2H2O+O2+4e-== 4OH-;当水膜呈酸性时发生析氢腐蚀,负极反应为:Fe-2e-==Fe2+,正极反应为:2H++2e-==H2。钢铁的电化学腐蚀以吸氧腐蚀为主。故答案为C项。
5.判断原电池的电极
例6.(2001年广东高考化学题)镍镉(Ni-Cd)可充电电池在现代生活中有广泛应用,它的充放电反应按下式进行:![]()
由此可知,该电池放电时的负极材料是( )
A.Cd(OH)2 B.Ni(OH)2 C.Cd D.NiO(OH)
解析:此电池放电时为原电池反应,所列反应由右向左进行,Cd元素由0价变为+2价,失去电子,被氧化,故Cd是电池的负极反应材料。本题答案为C项。
例7.(2001年上海高考化学题)铜片和锌片用导线连接后插入稀硫酸中,锌片是( )
A.阴极 B.正极 C.阳极 D.负极
解析:铜片和锌片用导线连接后插入稀硫酸中形成了原电池,由于金属活动性Zn>Cu,故Zn为负极。答案为D项。
6.原电池原理的综合应用
例8.(2004年天津高考理综题)下图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是 ( )
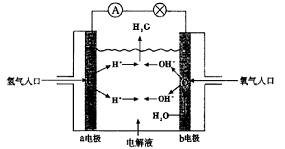
A.a电极是负极
B.b电极的电极反应为:4OH--4e-== 2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
解析:分析氢氧燃料电池原理示意图,可知a极为负极,其电极反应为:2H2-4e-==4H+,b极为正极,其电极反应为:O2+2H2O+4e-==4OH-,电池总反应式为:2H2+O2==2H2O。H2为还原剂,O2为氧化剂,H2、O2不需全部储藏在电池内。故答案为b项。
例9.(2004年江苏高考化学题)碱性电池具有容量大、放电电流大的特点,因而得到广泛应用。锌—锰碱性电池以氢氧化钾溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+H2O(l) == Zn(OH)2(s)+Mn2O3(s),下列说法错误的是( )
A.电池工作时,锌失去电子
B.电池正极的电极反应式为:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)
C.电池工作时,电子由正极通过外电路流向负极
D.外电路中每通过O.2mol 电子,锌的质量理论上减小6.5g
解析: 该电池的电解液为KOH溶液,结合总反应式可写出负极反应式:Zn(s)+2OH-(aq)-2e- == Zn(OH)2(s),用总反应式减去负极反应式,可得到正极反应式:2MnO2(s)+H2O(1)+2e- == Mn2O3(s)+2OH-(aq)。Zn为负极,失去电子,电子由负极通过外电路流向正极。1mol Zn失去2mol 电子,外电路中每通过O.2mol 电子,Zn的质量理论上减小6.5g。故答案为C项。

- 全部评论(0)
