漂白粉中的有效氯是怎样测定的?
时间:2007-12-03 11:36 来源: 作者:易友生 点击: 次 所属专题: 漂白粉
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
将Cl2通入冷的含有1%水分的消石灰中,就得到了次氯酸钙和碱式氯化钙的混合物,这就是漂白粉。
3Ca(OH)2+2Cl2====Ca(ClO)2+CaCl2·Ca(OH)2·H2O+H2O
漂白粉是混合物,它的有效成分是Ca(ClO)2。将漂白粉溶于水,次氯酸钙不稳定,遇水即发生水解反应。
Ca(ClO)2+2H2O Ca(OH)2+2HClO
Ca(OH)2+2HClO
当溶液中碱性增大时,漂白作用减弱,因此必须除去Ca(OH)2,工业上使用漂白粉一般要加入少量的酸,如醋酸或稀盐酸,以除去Ca(OH)2,促进Ca(ClO)2的水解。但家庭用漂白粉不用加酸,其反应原理为:
Ca(ClO)2+H2O+CO2====CaCO3↓+2HClO
在漂白粉中加盐酸或硫酸等强酸后,即有Cl2产生
Ca(ClO)2+CaCl2·Ca(OH)2·H2O+6HCl====3CaCl2+5H2O+2Cl2
(因Cl2+H2O H++Cl-+HClO为可逆反应,强酸性溶液中Cl-可被强氧化剂HClO氧化成为Cl2)
H++Cl-+HClO为可逆反应,强酸性溶液中Cl-可被强氧化剂HClO氧化成为Cl2)
反应所产生的氯叫做“有效氯”,漂白粉的质量是按有效氯的含量,以及它能长时间保存有效氯的能力来决定的。
有效氯的测定方法是将漂白粉与强酸作用放出的氯气通入含I-的溶液,再用标准的Na2S2O3溶液以淀粉作指示剂,滴定被氯置换出来的碘。
Cl2+2I-====2Cl-+I2
I2+2Na2S2O3====Na2S4O6+2NaI
当溶液蓝色消失,即可通过加入Na2S2O3的量,换算出有多少氯气产生,从而可求出氯在样品中的质量百分数。有效氯的百分含量是表示漂白粉的氧化能力的。一般工业漂白粉约含有效氯35%。
如:现为了测定一瓶漂白粉的有效氯的质量百分含量(x%),进行了如下实验。称取漂白粉样品2.00 g,加水研磨后,转入250 mL容量瓶内,用水稀释至刻度。摇匀后,取出25.0 mL,加入过量的KI溶液和过量的稀硫酸后,静置。待漂白粉放出的氯气与KI完全反应后,用0.1000 mol·L-1的Na2S2O3标准溶液滴定反应中生成的碘。滴定时用去Na2S2O3溶液 20.0 mL。试由上述数据计算该漂白粉的x%。
由反应方程式可知,消耗Na2S2O3的物质的量正好等于碘的物质的量的二分之一,而碘的物质的量正好等于氯气的物质的量。
所以,消耗Na2S2O3的物质的量为0.1000 mol·L-1×0.02 L=0.002 mol
I2和Cl2物质的量均为0.002 mol×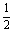 =0.001 mol
=0.001 mol
x%=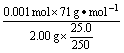 =35.5%
=35.5%
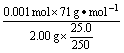 =35.5%
=35.5% (责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
