化工生产反应原理----无机推断题解题又一突破口
时间:2020-03-30 21:51 来源: 作者:易友生 点击: 次 所属专题: 化工生产 无机推断突破口
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
无机推断题解题突破口较多,常见的有物质特征颜色、特征状态、特征现象、特征反应、特征反应条件等。此外,在近年的高考题中还出现了以化工生产反应原理为突破口的推断题。这就要求在学习中注意总结归纳高中化学涉及到的化工生产反应原理。现小结如下:
制备的物质 | 反 应 原 理 |
硫 酸 | 4FeS2+11O2 2SO2+O2 SO3+H2O==H2SO4 |
硝 酸 | 4NH3+5O2 2NO+O2==2NO2 3NO2+H2O==2HNO3+NO |
合成氨 | N2+3H2 |
玻 璃 | Na2CO3+SiO2 CaCO3+SiO2 |
漂白粉 | 2CI2+2Ca(OH)2==CaCI2+Ca(CIO)2+2H2O |
氯碱工业 | 2NaCI+2H2O |
炼 铝 | 2AI2O3 |
炼 铁 | Fe2O3+3CO |
二氧化碳 | CaCO3 |
熟记以上反应原理后,请看一道高考题:
例.(2003年广东高考化学试题)根据下列反应框图填空,已知反应①是工业上生产化合物D的反应,反应⑤是实验室鉴定化合物E的反应。
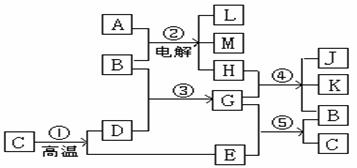
⑴ 单质L是 。
⑵ 化合物B是 。
⑶ 图中除反应①以外,还有两个用于工业生产的反应,是 和 (填代号)。它们的化学反应方程式分别是 和 。
解析:根据题意,反应①是由一种物质高温分解生成两种化合物的工业生产的反应,可大胆推测此反应为高温分解CaCO3生成CO2和CaO;反应②是两种物质电解生成三种产物,可联想到电解NaCI溶液,生成物为NaOH、CI2和H2;反应③是由NaCI、H2O、CO2、CaO中的两种物质发生的化合反应,不难推出B为H2O,D为CaO,则A为NaCI,E为CO2,G为Ca(OH)2;反应④为Ca(OH)2与NaOH、CI2、H2三种物质之一的反应,显然是CI2与Ca(OH)2生成Ca(ClO)2、CaCl2和H2O的反应,这是工业上制漂白粉或漂粉精的反应原理;反应⑤则为实验室用Ca(OH)2溶液鉴定CO2气体的反应。
答案:⑴ H2 ⑵ H2O ⑶ ②,④
2NaCl+2H2O![]() 2NaOH+H2↑+Cl2↑;
2NaOH+H2↑+Cl2↑;
2Ca(OH)2+2Cl2==Ca(ClO)2+CaCl2+2H2O
下面请思考以下两道题:
1.(2004年江苏高考化学试题)下图中,A是一种无色液体,G是极易溶于水的碱性气体,Y是胃酸的主要成分,K是不溶于稀硝酸的白色沉淀,反应⑤是工业制X的主要反应之一。
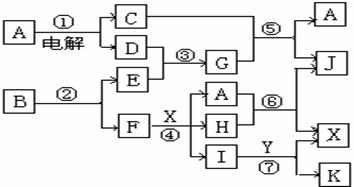
请按要求填空:
⑴ 写出下列物质的化学式:A______,E______,F______,Y______。
⑵ 反应⑤的化学方程式为_________________________ 。
⑶ 1molB通过反应②得到1molF,B中F的质量分数为72%,则B的化学式为_____。
2. 根据下列框图关系填空。已知反应①、③是工业生产中的重要反应,D为单质气体,E为无色刺激性气体,X由两种元素组成,常温下为无色液体,H为中学常见的强酸,H与E相对分子质量之间的关系为:Mr(H)-Mr(E)=34,又知C的焰色反应呈黄色,J为红褐色沉淀。
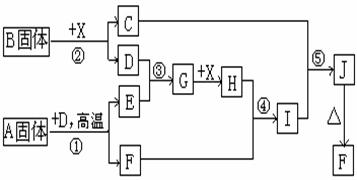
⑴ 化合物B中所包含的化学键有_________。
⑵ 反应④的离子方程式为_________________________________。
反应⑤的化学方程式为_________________________________。
⑶ 已知每生成16gE,放出106.5KJ热量,则反应①的热化学方程式为______________。
答案:
1.⑴ H2O N2 Ag HCl
⑵ 4NH3+5O2![]() 4NO+6H2O ⑶ AgN3
4NO+6H2O ⑶ AgN3
2.⑴ 离子键、非极性键
⑵ Fe2O3+6H+==2Fe3++3H2O Fe2(SO4)3+6NaOH==2Fe(OH)3↓+3Na2SO4
⑶ FeS2(s)+11/4O2(g)![]() 1/2Fe2O3(s)+2SO2(g);△H=-852KJ•mol-1
1/2Fe2O3(s)+2SO2(g);△H=-852KJ•mol-1

- 全部评论(0)
