碳酸钠制造史话
时间:2016-01-18 13:34 来源:未知 作者:刘玉林 点击: 次 所属专题: 纯碱工业
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
苏打,即碳酸钠,又称纯碱,它是一种弱碱性盐,用于制造玻璃、肥皂、洗衣粉、软水剂和助染剂等,还广泛用于冶金工业和化学工业中。18世纪以前,所有的苏打全部来自于天然资源——天然碱和海藻灰或“苏打灰”(BaRILLa,指海滨植物的烧灰),它们含有碳酸钠、碳酸钾及氯化钾等。但随着玻璃、肥皂和纺织品制造业等的发展,需要越来越多的苏打,因而天然资源显得不够用。由于当时人们已掌握了晒盐技术,海盐产量很大,价格便宜,因而人们就欲图利用海盐制造苏打(用化学方法制得的苏打相对地说比取自天然资源的要纯净,故苏打又称纯碱)。为此,法国科学院甚至在1775年设立10万法郎的奖金用于奖励发明出将海盐转化为苏打工艺的人。
第一种广泛地应用于生产的苏打制造工艺是法国人路布兰(N.LEBLaNC,1742-1806)发明的,他在1791年获得此项专利。这种苏打制造工艺现在称为路布兰法。在这种工艺中,将原料硫酸和氯化钠在一个炉子中混合,即产生硫酸钠和氯化氢气体,然后用木炭将硫酸钠还原为硫化钠,后者再与白垩石(CaCO3)或石灰(CaO)反应,即得到所需产物苏打和一种难闻的副产物硫化钙。上述过程用化学反应方程式表示即:
2NaCl+H2SO4![]() Na2SO4+2HCl↑,Na2SO4+4C=Na2S+4CO↑;Na2S+CaCO3=Na2CO3+CaS
Na2SO4+2HCl↑,Na2SO4+4C=Na2S+4CO↑;Na2S+CaCO3=Na2CO3+CaS
反应后所生成的熔融物中,一般含碳酸钠43-44%。不过,这样的苏打中还含有相当量的硫化钠等物质,故在蒸发前须用烟道气(主要含二氧化碳)处理,使硫化钠、铝酸钠及硅酸钠都变成碳酸钠,再经澄清、倾析、蒸发,碳酸钠即从溶液中以Na2CO3·H2O晶体形式析出,最后将其放在焙烘炉内烘干即成无水碳酸钠。
将近一个世纪以内,上述路布兰法是制造苏打的主要方法。1814年,洛希(LOsH)把路布兰法介绍到英国。但由于当时英国征收盐税,因此该法在英国并未立即应用于苏打制造。直到1823年英国政府免除盐税后,路布兰法才得到应用。但是,没过多久,路布兰法的缺点就暴露出来了:生产过程中释放出有刺激性气味的氯化氢气体,它损害人的健康和工厂周围的庄稼,并且腐蚀建筑物中的钢铁构件及砂浆;同时,产生大量的废物硫化钙,它不断地释放出有坏鸡蛋气味的硫化氢气体。这引起了工厂周围居民的强烈不满。
英国的第一家路布兰法苏打制造厂出现在利物浦市郊,这里离主要原料之一食盐产地不远,并且交通方便。该厂的先驱是一位名叫穆斯普瑞特(J.MUspRaTT)的冒险者。当工厂附近的居民埋怨他的工厂产生酸雾时,他不得不将工厂迁至另一个地方去了。
1836年,英国的哥塞(W.GOsSAgE,1799-1877)为解决路布兰法的上述问题,对该法进行了如下两点改进。改进之一是他设计了一种反应塔,让水从塔上边喷流下去以吸收苏打制造过程中产生的氯化氢气体,他的第一座这种吸收塔是用一台旧风车改制的。哥塞对路布兰法所进行的第二点改进是他设计了一种用二氧化碳和空气处理硫化钙以回收硫的方法,用化学反应方程式表示为:
CaS+CO2+H2O=CaCO3+H2S↑;2H2S+O2=2H2O+2S
但是,直到1860年哥塞的上述改进才被英国的苏打工厂所采用。他们将酸雾用水吸收后制得盐酸,又将盐酸氧化成氯气,再用氯气制造漂白粉,而对硫化钙进行处理后除了回收硫以外,还进一步生产硫酸、芒硝、硫代硫酸钠等。此后,路布兰制碱法在英国迅速传播开去。
但是,路布兰法生产流程较长,且产品不纯(含碳酸钠85-92%);另外,其基本原料硫酸钠当时是用硫酸和食盐反应制得,因而生产成本较高,所以,许多人欲图改进路布兰法,想用食盐代替硫酸钠作原料。从1811年开始,有不少人研究过用食盐和碳酸氢铵制苏打,而且确曾试制出少量的产品,建立了几个初期的氨碱法工厂。但由于当时在工艺技术和设备结构方面还不成熟,这些工厂均先后倒闭。
比利时的苏尔维(E.SOLVAY,1838-1922)在前人研究的基础上继续改进,特别是在设备方面下了很大的功夫,终于在1860年成功地用氨、二氧化碳和食盐合成出了苏打,这一种苏打制造方法被后人称作苏尔维法,当时苏尔维只是一位23岁的青年技术人员。从此以后,路市兰法就失去了它原来的统治地位,到了19世纪末,路布兰法就基本上不用于生产中了。
在苏尔维法中,首先是氨与二氧化碳、水反应生成碳酸氢铵,后者然后与食盐反应产生微溶于水的物质碳酸氢钠,这样得到的碳酸氢钠晶体是粗品,其中含有许多杂质,如碳酸氢铵、氯化铵、氯化钠,加热焙烧后,产品基本上全是碳酸钠,其中只含少量氯化钠了。主要化学反应方程式如下:
NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NaHCO3+NH4Cl;2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
NH4HCO3![]() NH3↑+CO2↑+H2O;NH4Cl
NH3↑+CO2↑+H2O;NH4Cl![]() NH3↑+HCl↑
NH3↑+HCl↑
焙烧过程中放出的氨和二氧化碳气体都可以回收再用。
苏尔维法从理论上说似乎很简单,但实际上大规模生产过程中会有许多氨和二氧化碳气体跑掉。苏尔维通过设计一个连续工艺而解决了这一气体丢失问题(路布兰法是非连续工艺)。他设计了一个塔,让二氧化碳在塔中从下往上流,与从上而下的用氯气饱和的食盐水相接触,此时即产生碳酸氢钠沉淀;在将原料引入另一反应塔内后将前一塔中生成的碳酸氢钠取出来。
苏尔维是一位精制盐者的儿子,他曾在其叔父开办的煤气厂做事,他曾说过他是“在氨气中长大的”,这段早期经历对他后来研究出苏打制造设备是有裨益的。
1861年,苏尔维和他的弟弟建立了一个试验工厂,进行进一步研究,以期获得工业化的各种条件并探寻合用的设备。第二年,他们就成功地实现了苏打的工业化生产,不过每天只能生产约300kg 苏打。第一个真正的苏尔维法苏打工厂是苏氏兄弟于1863年在比利时的库莱特建立的,到1872年,该厂每天已能生产10T苏打,产品还在巴黎展览会上展出过。
1873年,英国化学工业家门德(L.MOnd)和企业家布鲁纳在获得政府许可后在英国开办了一家苏尔维法苏打厂。门德由于曾经发明了一种萃取镍的方法而闻名,布鲁纳则是利物浦的一位具有丰富化工生产经验的企业家,尽管他们两人都熟悉工业化学,但他们在苏打制造中并不十分顺利。
门德担任该厂的经理,每周工作6天,每天工作12H,晚上则睡在机器旁的一个工作台上,并且在工作台上安装了一个报警铃以便在运转的机器出故障时闹醒他。他曾这样描述他的工厂:“成千上万只接头和旋钮将许许多多管子首尾相连,并且所有的设备都要不漏气”。
门德通过如下几点改进而使苏尔维法变得实用:利用旋转过滤器分离碳酸氢钠沉淀;安装一个连续式蒸氨器;控制反应温度、压力和反应物浓度。
1884年,美国人也在纽约州西纳卡斯市建立了该国第一座苏尔维法苏打工厂。随后,该生产工艺迅速传播到了美国其它各工业中心。
苏尔维制碱法具有原料消耗少,生产连续,产量大,质量高,劳动力省,废物处理容易等优点,因而在世界各地广泛应用。乃至本世纪20年代,该法已完全取代了路布兰法。
但是,苏尔维法存在一个严重缺点,即食盐利用率较低:只有73-75%的食盐转化为碳酸氢钠,加上盐水滴漏及精制盐时的损耗,食盐的总利用率约只有70%。这一缺点是由我国制碱专家侯德榜弥补的。
本世纪初,我国知名的实业家范旭东为振兴民族工业,在“久大精盐公司”的基础上,在天津塘沽筹建“永利制碱公司”。但由于当时苏尔维法为英国“帝国化学工业公司”所垄断,塘沽碱厂碰上了许多技术难题,多次试验均遭失败。该厂就聘请正在美国攻读化学工程专业博士学位的侯德榜(1890-1974)为总工程师,改进制碱技术。
侯德榜在美留学期间就对外国资本家的技术封锁十分愤慨,为了振兴我国民族工业,他毅然接受塘沽碱厂的邀请,于1921年回国,专心研究制碱技术,致力于工艺和设备的改进。1922年,侯德榜和范旭东终于在天津创建了永利化学工业公司塘沽碱厂(今化学工业部塘沽碱厂前身),这是我国第一家制碱厂。在侯德榜的主持下,塘沽碱厂克服了资金和技术上的困难,成功地掌握了苏尔维法制碱工艺。1923年该厂开始生产苏打,1925年该厂产“红三角”牌苏打获得巴黎万国博览会的金质奖章。1929年该厂生产走上正轨,日产苏打一百多吨,产品远销日本及东南亚各国。
1938年,塘沽碱厂落入日寇手中。侯德榜坚贞爱国,决心在四川建设华西化工基地。经过多方调查研究以后,他在四川五通桥筹建永利川厂。但四川用的食盐全是从井中取出的卤水熬制成的,而五通桥一带又只有低浓度的黄卤水,需经熬浓才能用于制造苏打,如果这样制苏打,成本就会很高;并且,苏尔维法中食盐利用率只有70%左右,因此,必须寻求新的苏打制法。
当时,德国新发明了“察安法”苏打制造工艺,其中食盐的利用率高达90%,且能同时生产出氯化铵。侯德榜等人马上赴德考察,但德方不许他们去生产现场参观,在谈判中又百般刁难,因而侯德榜未能取得什么有益的经验。他转赴美国纽约,打算在这里亲自进行研究,因为当时四川正处于战乱中,设备、药品和资料等极为缺乏。1939年春天,侯德榜着手在香港建立实验室,他在纽约通过信件指导一些工程师进行研究。到1939年底,就大致确定了新的工艺路线,基本上摸清了各种工艺条件。1941年初,中试成功,得到了与实验室极为相近的数据,并进一步摸清了一些操作条件,成功地实现了新法制苏打。
侯德榜的新的苏打制法称为联合制碱法,它是将合成氨工艺与苏尔维制碱法联合起来,同时生产苏打和氯化铵。这种方法于1943年由当时的中国化工学会在重庆开会定名为“侯氏制碱法”。
侯氏制碱法是利用半水煤气的转化来制备氮气和氢气,并以此化合成氨气,同时有副产物二氧化碳产生;接着用氨和二氧化碳及食盐制苏打和氯化铵。用化学反应方程式表示为:
C+H2O+(H2+O2+N2)![]() CO2+H2+N2;3H2+N2==2NH3;NH3+CO2+H2O==NH4HCO3
CO2+H2+N2;3H2+N2==2NH3;NH3+CO2+H2O==NH4HCO3
NH4HCO3+NaCl==NaHCO3+NH4Cl 2NaHCO3![]() Na2CO3+CO2↑+H2O
Na2CO3+CO2↑+H2O
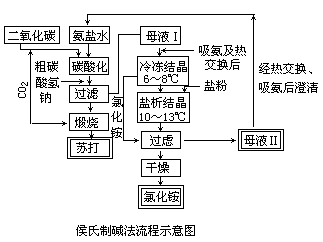
本来,在苏尔维法中,生成碳酸氢钠的同时有氯化铵生成。但该法中并未分离出氯化铵,而是在滤出沉淀的碳酸氢钠后,在含氯化铵和未反应的食盐等的溶液中加石灰乳蒸馏,这样其中的氯化铵就分解掉了,剩下的含氯化钙(85~100g·L-1)和食盐(40~50g·L-1)的溶液(还含有氢氧化钙、碳酸镁、硫酸镁、硅酸盐、碳酸钙、硫酸钙及过剩石灰等)则排放废弃了。这种废液难以处理,使厂区附近田地盐碱化。而在侯氏制碱法中,则通过冷析、盐析等方法使上述混合液中氯化铵以晶体形式分离出来,用作氮肥,并将剩余溶液(主要含食盐)返回碳化塔,供制碳酸氢钠(见图),这样,食盐的利用率从苏尔维法中的70%左右提高到了95%以上。一般地说,联合制碱厂的苏打成本比氨碱厂(即苏尔维法苏打厂)要低40%,而氯化铵的成本比含氮量相近的其它氮肥的也要低。
在某些芒硝或智利硝石资源丰富的地区,也有用芒硝或智利硝石制造苏打的,其主要原理用下述总反应分别表示如下:
Na2SO4+2CO2+2H2O+2NH3=2NaHCO3+(NH4)2SO4;NaHCO3![]() Na2CO3,(NH4)2SO4及未反应的Na2SO4混合液直接用作液体肥料;
Na2CO3,(NH4)2SO4及未反应的Na2SO4混合液直接用作液体肥料;
NaNO3+CO2+H2O+NH3=NaHCO3+NH4NO3;NaHCO3![]() Na2CO3,NH4NO3及未反应的NaNO3混合液也可直接用作液体肥料。
Na2CO3,NH4NO3及未反应的NaNO3混合液也可直接用作液体肥料。
但不论是用芒硝还是用智利硝石代替食盐生产苏打,都对原料有特殊要求,而食盐则是更普遍的原料,所以至今各国都主要使用食盐制造苏打。
就苏打的生产方法来说,日前世界范围内仍以苏尔维法为主,约70%的苏打是用此法生产的,其次为侯氏制碱法和天然碱加工制碱法(某些国家天然碱资源比较丰富),此外还有霞石制碱法(霞石是一种主要成分为硅酸铝钠的复杂矿石,是苏联的特产,因而该法主要为苏联所采用——以霞石为原料炼铝联产苏打)和电解烧碱液制碱法(该法的兴起是由于美、日等国水银法电解烧碱过剩,其大致过程为:钠汞齐解汞得烧碱液,烧碱液通入二氧化碳得碳酸氢钠沉淀,煅烧碳酸氢钠即得苏打)。

- 全部评论(0)
