铜锌原电池实验中极化和去极化方法
时间:2016-03-18 22:33 来源:浙江省温岭中学 作者:方丽妹 点击:次 所属专题: 电极极化 铜锌原电池
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、极化及其产生的原因
广义的极化是指:事物在一定条件下发生两极分化,使其性质相对于原来状态有所偏离的现象。如分子极化(偶极矩增大)、光子极化(偏振)、电极极化等。
电化学中的极化是指电极极化:电极电势E偏离了没有净电流通过时的电势的现象,通称电极极化。对于发生简单电极反应的“单一电极”,其无电流通过时的平衡电极电势Ep可根据能斯特公式计算。如该电极的可逆性较好,Ep也可直接测量,即Ep值较为确定。此时的电极极化η=E-Ep称为超电势。对于可有多个反应发生的“多重电极”,无净电流时的电势称静态电势Ei=0,电极极化为E-Ei=0。多重电极的典型实例即腐蚀电极。
原电池实验中的电极极化是指:电流通过电极时,电极电势偏离平衡电极电势的现象。
电极发生极化的原因:是因为当有电流流过电极时,在电极上发生一系列的过程,并以一定的速度进行,而每一步都或多或少地存在阻力。要克服这些阻力,相应地各需要一定的推动力,表现在电极电势上就出现这样那样的偏离[4]。
原电池实验中的极化产生的原因是:腐蚀电池作用一经开始,其电子流动的速度大于电极反应的速度。在负极,电子流走了,离子化反应赶不上补充;在正极,电子流入快,取走电子的正极反应赶不上,这样负极电位向正移,正极电位向负移,从而缩小电位差,减缓了腐蚀。
关于氢离子在正极反应时的机理的研究:从本世纪三十年代开始关于氢离子在正极反应时的机理的研究有了很大的发展,提出了不同的理论,例如迟缓放电理论和复合理论等。在不同的理论中也有一些共同之点,如:都提出H+的放电可分为几个步骤进行。有:
(1)H3O+从本体溶液中扩散到电极附近。
(2)H3O+从电极附近的溶液中移到电极上。
(3)H3O+在电极上以下列机理之一而放电。
其一为H3O+在电极表面上放电而形成吸附在电极表面的原子(称为伏尔墨反应)H3O++Me+e-=MeH+H2O其中Me表示金属电极。
其二为H3O+和已经被吸附在电极表面上的氢原子H反应(称为海洛夫斯基反应)H3O++MeH+e-=2Me+H2+H2O
(4)H原子化合为H2(称为塔菲尔反应)MeH+MeH 2Me+H2
2Me+H2
(5)H2从电极上扩散到溶液内或形成气泡逸出。
迟缓放电理论认为第三步最慢,而复合理论则认为第四步即吸附在电极上的氢原子结合为氢气的步骤最慢。
复合理论把超电势归之于在电极表面上吸附的原子氢复合成为分子氢这一过程的迟缓性,即假设下述步骤控制了这个反应的速度:MeH+MeH 2Me+H2不同金属对于上述反应具有不同的催化作用。这些联系被认为是这个理论的一个重要论据。因为如果反应速度取决于氢原子的复合,那么在对该反应催化性能愈高的金属来说,氢的超电势就应该越低。实验证实了这种关系,可表示如下:
2Me+H2不同金属对于上述反应具有不同的催化作用。这些联系被认为是这个理论的一个重要论据。因为如果反应速度取决于氢原子的复合,那么在对该反应催化性能愈高的金属来说,氢的超电势就应该越低。实验证实了这种关系,可表示如下:
Pt,Pd,W,Ni,Fe,Ag,Cu,Zn,Sn,Pb
(从左到右催化活性减弱,超电势增加)
铜锌原电池的极化作用:在铜锌电池实验中,开始时,锌片上没有气泡,铜片上产生气泡(氢气)。但不久后,锌片上也慢慢产生气泡,这是因为铜片上产生气泡时,气泡附着在铜片上,使得铜片上始终有许多微小气泡覆盖,阻碍了氢离子在铜片上得到电子,这就是电极的极化作用。根据极化产生的不同原因,通常分为浓度差极化和电化学极化。
2、消除极化作用(去极化)的途径及其效果研究
去极化方法:能消除或减弱极化作用的方法。在腐蚀过程中,金属离子化反应产生出的电子,如果没有物质将其吸收,则阳极过程会由于产生极化而减慢甚至停止。在中性介质中,溶解氧能够吸收电子进行还原反应,故腐蚀就容易继续进行下去;在酸性介质中的氢离子也是如此。氧和氢离子是去极化剂。它们的存在对防腐非常有害。
铜锌原电池实验中消除极化作用的途径:在铜锌原电池中,若能将铜片上的气泡不断除去,或者铜片不断振动,或者采用盐桥连接的方法将锌与氢离子分开,就可以避免极化的产生。另外,也可以采用外加去极化剂的方法来减少极化作用,去极化剂指的是外加一种易与电极反应产物发生反应的物质,如在铜锌原电池中加入高锰酸钾、重铬酸钾、双氧水等强氧化剂,使铜电极上不易产生氢分子,从而减少了极化作用,增强了原电池的放电效果。
高中实验化学教学中铜锌原电池的去极化方法:
铜电极氧化法:在进行铜锌原电池实验前,把铜电极放在酒精灯上烘烤,使铜极表面氧化转化为氧化铜作为电极可消除阴极的极化作用。原理:CuO+2H=H2O+Cu
二氧化锰法:在一烧杯中放入MnO2粉末和少量水,搅拌成糊状,涂于铜极表面并在酒精灯上加热烘干后作为阴极使用可消除极化作用。原理:2H++MnO2+2H=Mn2++2H2O
加入强氧化剂法:在铜锌电极的阴极附近加入1-2g高锰酸钾、重铬酸钾晶体或5-10ml6%双氧水溶液可消除极化作用。原理:MnO4-+5H+3H+=Mn2++4H2O、Cr2O72-+8H++6H=2Cr3++7H2O、H2O2+2H=2H2O等。
铜锌原电池实验中各种去极化方法的效果比较:
(1)研究目的:比较铜锌原电池实验中各种去极化方法的作用效果
(2)研究方法:控制变量法、对照实验法
(3)研究内容:
①测量不加去极化剂的铜锌原电池电流强度的大小
②测量加入高锰酸钾晶体后铜锌原电池电流强度的大小
③测量加入5ml6%双氧水溶液后铜锌原电池电流强度的大小
④测量铜极表面涂上二氧化锰后铜锌原电池电流强度的大小
⑤测量铜电极氧化后铜锌原电池电流强度的大小
(4)研究过程设计:(如表1)
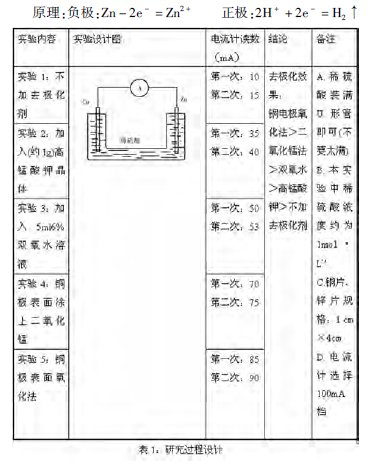
注:
1、重铬酸钾有毒,不适合学生实验,因此没作统计。
2、课本中实验设计的稀硫酸浓度为4 mol·L-1则现象更明显。
3关于铜锌原电池实验方案的改进意见
高中《实验化学·苏教版》课本中对铜锌电池的设计是用一块海棉把铜片和锌片固定后,放入稀硫酸中构成原电池,这样效果不好且增加了实验老师的工作负担,另外用高锰酸钾作去极化剂不但效果不明显且造成极大浪费和污染。作为学生实验把此实验设计成为如上图所示装置、去极化方法选用铜电极氧化法则更适合。理由是:其一改用U形管固定两极距离可减少实验老师工作量且易于操作;其二改用加热铜片的方法则去极化效果更好且不造成极大浪费和污染。

- 全部评论(0)
 616565782@qq.com 评论 铜锌原电池实验中极化和:大神有个问题请教一下,既然极化作用是由于电子流动速度远大于离子化反应的速度,那是
616565782@qq.com 评论 铜锌原电池实验中极化和:大神有个问题请教一下,既然极化作用是由于电子流动速度远大于离子化反应的速度,那是 616565782@qq.com 评论 铜锌原电池实验中极化和:大神有个问题请教一下,既然极化作用是由于电子流动速度远大于离子化反应的速度,那是
616565782@qq.com 评论 铜锌原电池实验中极化和:大神有个问题请教一下,既然极化作用是由于电子流动速度远大于离子化反应的速度,那是
