电池的电极介绍
时间:2021-12-21 11:53 来源:未知 作者:方丽妹 点击: 次 所属专题: 电极判断
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电池的电极是组成电池的主要部件之一。它是与 电池的一个极端可导电性相连的导电部件,电极反应 在它与电解质形成的界面上进行。电极反应(elec-trode reaction)是指在电解质与电极之间伴有电子 传递的化学反应,也即在电解质与电极之间进行氧化 反应或还原反应。在电池中两个电极通常分别以正极 和负极相称,而阴极和阳极的名称通常在电镀和腐蚀 等反应中使用。
1.1 正极和负极
电池的正极(positive electrode )是电池两个 电极中具有高电位的电极,低电位电极为电池的负极 (negative electrode ),按照惯例分别指在放电时发 生还原反应的电极和发生氧化反应的电极。如铅酸蓄 电池的两个电极是二氧化铅正极和铅负极,其电极反应如下:
放电时的正极反应为:PbO2+SO42-+4H++2e-=PbSO4+2H2O (1 )
从式(1)看出:反应有伴随电子传递发生;反应过 程中,Pbo2得到2e、Pb从+4价变为+2价,Pb的价 数在反应中降低,PbO2还原为PbSO4,对PbO2来说 是得到2e-发生还原反应。
放电时的负极反应为:Pb+SO42-=PbSO4+2e- (2 )
同样地,放电反应也伴随电子传递,负极向外电路放 出2e-,反应过程中Pb放出2e-,从零价上升为+2价 的PbSO4,此时Pb被氧化成PbSO4,发生氧化反应。 这样放电时,电子就从负极通过外电路流向正极,由 于电流方向与电子流动方向相反,则电流从电池正极 流向负极。
蓄电池放完电后需要借助外电源对其进行充电, 充电时总是外电源的正极接电池的正极,负极接负极,按一定电流和终止电压等条件进行充电。
充电反应如下:
正极的充电反应是式(1 )的逆反应:PbSO4+2H2O= PbO2+SO42-+4H++2e- (3 )
电极反应是失去电子进行氧化反应。
负极充电反应是式(2)的逆反应,即 PbSO4+2e-=Pb+SO42- (4 )
电极反应是得到电子进行还原反应。
综合铅酸蓄电池的放电充电的反应,其反应为下式:
PbO2+Pb+2SO42-+4H+ 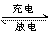 2PbSO4+2H2O (5 )
2PbSO4+2H2O (5 )
电池在充电状态或放电状态或充放电的过程中,电池 的正极和负极的极性不变,且正极的电位总是高于负极的电位。
1.2阴极和阳极
阴极(cathode )通常是指还原反应的电极,阳 极(anode)通常是指氧化反应的电极。若仍以铅酸 蓄电池为例,放电时发生还原反应(式(1))的正极 是阴极,发生氧化反应(式(2))的负极是阳极,此 时阴极电位高于阳极。充电时外电源的正极所接的电 池正极为阳极,发生氧化反应(式(3)),负极所接 的电池负极为阴极,发生还原反应(式(4)),此时阳极电位高于阴极。可知电池采用阴极、阳极的话, 在充放电时电池的正极成为阳极阴极交替变化,负极 是阴极阳极交替变化,阴极和阳极的极性会发生变 化。尽管发生变化,但阴极发生还原反应与阳极发生 氧化反应是始终不变的。
阴极和阳极通常不在电池中使用,而在电镀和腐 蚀等方面使用。但在一些杂志和报刊中的某些电池文 章中会有出现如阴极反应、阴极材料和阴极组成等 词,这是直译国外文章中cathode所致,这种称法是不规范的,在国外也属不规范的,其要按IEC的规定 称法,在电池中使用正极和负极。其实,上述的阴极 是指电池带(充)电状态为正极,因此写中文或英文 时要将阴极改为正极较妥。
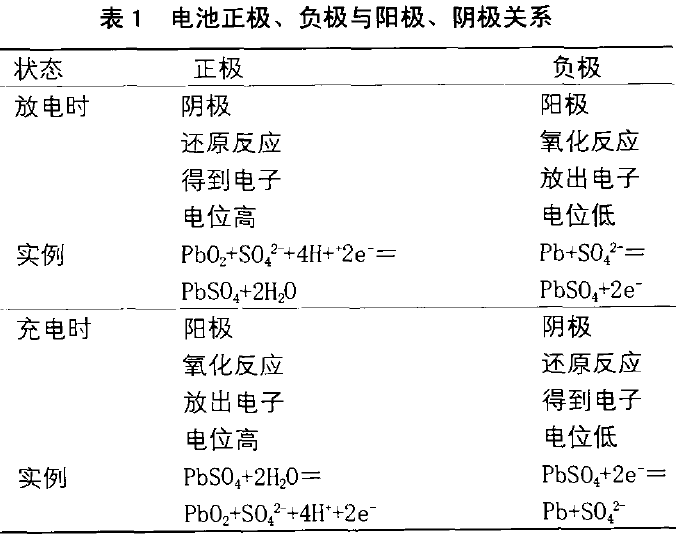
综合上述的正极、负极与阴极、阳极的定义,现 以铅酸蓄电池为例对其进行概括(见表1 )。

- 全部评论(0)
