超电势在中学化学中的应用
时间:2021-12-21 16:15 来源:未知 作者:王春涛 点击:次 所属专题: 超电势
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
物理化学中的电化学知识告诉我们,电对的电极电势数值越大,其氧化态的氧化性越强;电对的电极电势的数值越小,其还原态的还原性越强。
可逆电极的电极电势为;
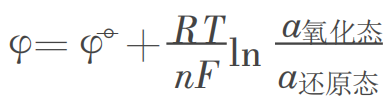
其中中![]() 为电极的标准电极电势,α氧化态为电对氧化态的活度,α还原态为电对还原态的活度。
为电极的标准电极电势,α氧化态为电对氧化态的活度,α还原态为电对还原态的活度。
而实际电极的电极电势∶

其中![]() ,
,![]() 分别为阳极超电势和阴极超电势。所以,严格地说,一个实际的原电池或电解池,其析出电极电势应为:
分别为阳极超电势和阴极超电势。所以,严格地说,一个实际的原电池或电解池,其析出电极电势应为:
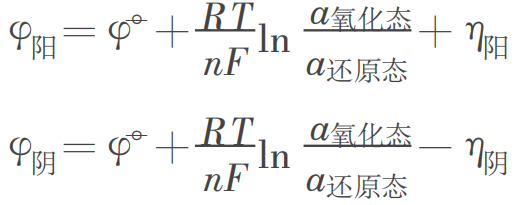
但通常金属离子在电极上析出的超电势很小,可认为![]() =0,故金属离子在阴极上的析出电势为:
=0,故金属离子在阴极上的析出电势为:
![]()
可以忽略超电势,其实际析出电势与可逆电极电势基本一 致。而对于有气体参加的电极反应,由于气体反应的迟缓性,造成气体的实际析出电势与可逆析出电势有较大的偏差。即有较大的超电势,此时的超电势![]() 就不能忽略。
就不能忽略。
例如H2 和 O2 的析出都有较大的超电势。再者对于无气 体反应的电极如果![]() 数值的绝对值很大,则
数值的绝对值很大,则 ![]() 的数值主要由
的数值主要由![]() 决定。
决定。
故一般情况下,可以直接以![]() 来讨论电对的氧化还原性,但对于气体反应,必须考虑其超电势。
来讨论电对的氧化还原性,但对于气体反应,必须考虑其超电势。
下面我们讨论几个与中学电化学有关的问题:
1.电解时为什么在阴极常见阳离子的放电规律大体是:K+<Ca2+<Na+<Mg2+<Al3+<H+ < Zn2+<Fe3+<Sn2+<Pb2+<Cu2+<Hg2+< Ag+<Pt2+<Au3+
这是因为:
(1)根据电极电势表可知,在金属活动性顺序表氢以后的金属及其离子所组成的电极,其电极电势![]() 都大于零且由上而下逐渐增大。因为
都大于零且由上而下逐渐增大。因为![]() 值大的氧化态物质,易发生还原反应在 阴极上得到电子而首先放电,所以当溶液中只 有 H+及其在金属活动顺序表中位于 H 以后 的其他金属的阳离子,其放电顺序为:
值大的氧化态物质,易发生还原反应在 阴极上得到电子而首先放电,所以当溶液中只 有 H+及其在金属活动顺序表中位于 H 以后 的其他金属的阳离子,其放电顺序为:
H+<Cu2+<Hg2+<Ag+<Pt2+<Au3+
(2)在金属活动性顺序表氢以前的金属及其离子所组成的电极,其电极电势![]() 值皆为负,且由上而下逐渐减小,因而当溶液中只有 H+和这些金属离子时,好像应该是氢离子先放电,阴极上析出氢。但由于氢有较大的超电 势
值皆为负,且由上而下逐渐减小,因而当溶液中只有 H+和这些金属离子时,好像应该是氢离子先放电,阴极上析出氢。但由于氢有较大的超电 势![]()
据
![]()
知,其析出电势更负,能使位于氢前面不远的 金属(如 Zn、Fe 等)离子放电,而得到相应的金属。因而这些金属离子的放电顺序大体为:
K+<Ca2+<Na+<Mg2+<Al3+<H+ < Zn2+<Fe3+<Sn2+<Pb2+
2.电解时常见阴离子的放电顺序为: S2->I- >Br- >Cl- > OH- > NO3- > SO42- 这一规律是怎样获得的?
由标准电极电势表查得:
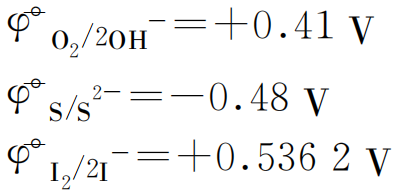
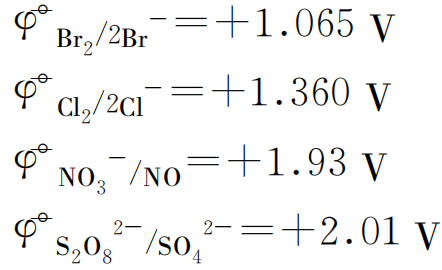
因为![]() 值小的还原态物质易发生氧化还原反应,在阳极失去电子首先放电,好像应该得出如下放电顺序: S2->OH- >I- >Br- >Cl- >NO3- > SO42-, 但因为在同一电极材料上 O2 的超电势较大,
值小的还原态物质易发生氧化还原反应,在阳极失去电子首先放电,好像应该得出如下放电顺序: S2->OH- >I- >Br- >Cl- >NO3- > SO42-, 但因为在同一电极材料上 O2 的超电势较大,![]() ,
,
据
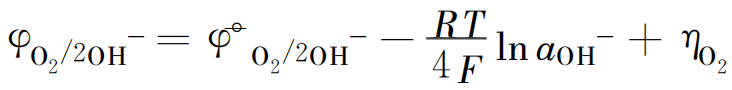
知O2 的实际析出电势增大,即![]() 增大,故高于
增大,故高于![]() ,但仍低于
,但仍低于![]()
故实际放电顺序 应该是:S2->I- >Br- >Cl- >OH- >NO3- > SO42-
3.为什么纯锌和稀硫酸反应开始较快,然 后变慢,滴入硫酸铜溶液后,反应速率又加快?
有人是这样解释的: 反应 Zn+H2SO4(稀)=ZnSO4+H2,开始时,因为没有 H2,所以反应较快,有 H2 产生后,由于 H2 浓度的影响,抑制了反应,速率变慢,滴入硫酸铜溶液后,形成了 Cu-Zn 原电池,所以反应加快。
笔者认为,这样的解释不够圆满。我认为,引起上述实验现象的原因有动力学因素,但主要是热力学因素。 开始,纯锌同稀硫酸反应为置换反应,其 反应速率较快。这由标准电极电势即可看出:
![]()
电动势 E=0-(-0∙76V)=0∙76 V > 0,故反应趋势较大。一旦产生了氢气,由于氢 在锌上析出的超电势太大,达-0∙70V,使氢锌电池电动势很快降为0∙06V,( E=+0∙76 V-0∙70V=+0∙06V),反应趋势变小,故反应速率减慢。 当滴入硫酸铜溶液,锌置换出硫酸铜中的铜,氢由在锌片上析出改为在铜片上析出,而 氢在铜上析出的超电势较小,只有-0∙20V,故使铜锌原电池的电动势变为+0∙50V,因而又加速了锌的溶解。

- 全部评论(0)
