黄铜矿(CuFeS2)中铁到底几价?
时间:2024-09-05 11:05 来源:化学一点通 作者:胡明生 点击:次 所属专题: 化合价 黄铜矿
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
近日看见一些老师讨论黄铜矿中Fe价态,觉得一些老师可能会有一些错误认识。所以决定本次给大家分享关于黄铜矿中Fe的化合价问题。一些老师认为黄铜矿中的Fe为+2价,理由我觉得可能是受一些辅导资料影响或者认为Fe3+与S2-会发生强烈的双水解,也可能有的老师认为Fe3+与S2-会发生氧化还原反应所以认为黄铜矿中Fe不可能为+3价。
那么该矿物中铁的化合价事实是多少呢?请看下列资料:
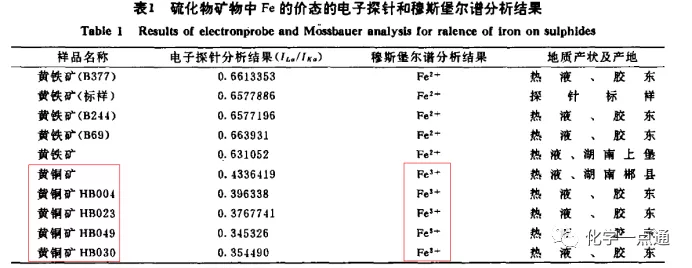
《某些硫化物矿物中Fe的价态电子探针分析》;作者:曹琳 于洪林 邱兆明(长春地质学院测试中心)
显然黄铜矿中Fe为+3价应该是没有问题的。那么如何理解该物质中Fe为+3价呢?Fe3+与S2-会发生强烈的双水解或发生氧化还原反应怎么认识呢?其实Fe3+与S2-反应非常复杂,既有氧化还原反应又有复分解反应既可能形成Fe(OH)3沉淀,又可能形成Fe2S3沉淀,Fe3+与还原为Fe2+后还可能形成FeS沉淀还可能形成Fe(OH)2沉淀。从沉淀反应看,我们知道Ksp小的一般会优先沉淀。我们看看各种沉淀的Ksp。Ksp[Fe(OH)3]=2.6×10-39、Ksp[Fe(OH)2]=2.6×10-17、Ksp[FeS]=6.3×10-18、Ksp[Fe2S3]=1.0×10-38(引自印永嘉-《大学化学手册》及王汉章等的《无机化学》)。显然pH增大才会形成Fe(OH)3或Fe(OH)2,而FeS、Fe2S3沉淀的形成取决于Fe2+、Fe3+与S2-的浓度大小。另外从电极电位看,酸性条件下:Fe3++e-=Fe2+ ϕø=0.771,S+2H++2e-=H2S ϕø=0.142(未查到HS-的电极电势);碱性条件下:Fe(OH)3+e-=Fe(OH)2+OH- ϕø=0.56,S+2e-=S2- ϕø=0.476。因此氧化还原反应也有竞争,pH较小时主要是铁离子与H2S的反应,从电极电势看这个反应比较容易,pH较大时可能就主要是Fe(OH)3与S2-的反应为主了(这个反应从电极电势看比前者要困难),如果再考虑HS-的反应则更为复杂。到这里我们会知道这个圈子有多乱了,不想再分析下去了,沉淀-沉淀反应竞争,氧化还原-氧化还原反应竞争,沉淀-氧化还原竞争。随着滴入先后,及反应过程中pH及各微粒浓度变化……不分析了直接上一个实验结果吧。

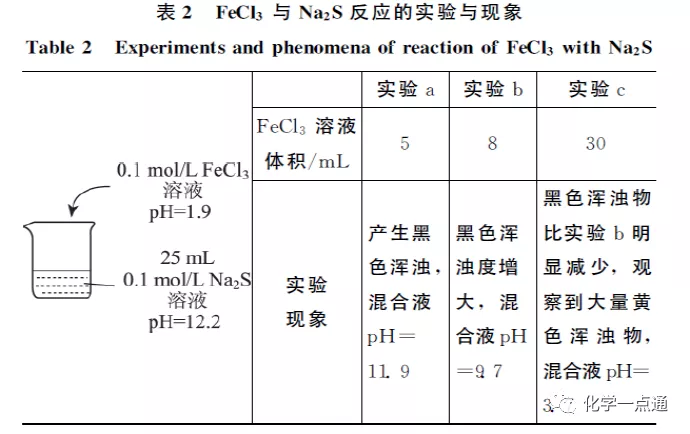
《碱性介质中S2-与Fe3+反应的实验探究》;作者:吴星 吕琳 徐丹悦(扬州大学化学化工学院)
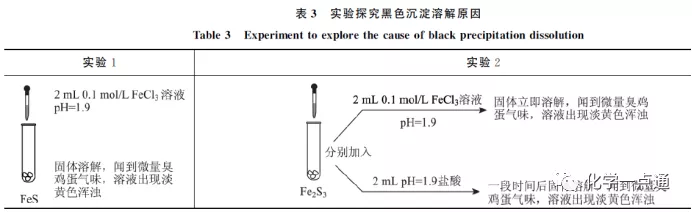
《以科学探究素养为导向的化学实验探究试题的命制—以氯化铁与硫化钠的反应现象为例》;作者:徐敏 郑晓红 李艳 刘春生
根据很多资料实际实验的研究结果,确实该反应是非常复杂的。在一定条件下是可以形成Fe2S3沉淀的,所以在特定的自然环境下形成含有Fe3+的CuFeS2(黄铜矿)也就非常自然。其实我们不要觉得两个微粒发生双水解或氧化还原它们就不可能组合成为物质。像AgI就是另一个例子,我们都知道Ag+氧化性较强,I-还原性较强(Ag++e-=Ag ϕø=0.7995,I2+2e-=2I- ϕø=0.5345),理论上银离子可以氧化碘离子,但由于AgI很难溶,由于氧化还原反应动力学的限制速度较慢,所以在竞争中沉淀反应赢得胜利。且随着沉淀反应的发生,银离子、碘离子浓度迅速下降,电极电势随之改变氧化还原反应从热力学角度也就不再反应了。
总结:根据一些资料综合分析,黄铜矿中的Fe价态应该为+3价是没有问题的。

- 全部评论(0)
