高考热点:百变的碳酸氢钠
时间:2022-10-13 19:27 来源:C3H3微信公众号 作者:张劲辉 点击: 次 所属专题: 碳酸氢钠01
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
碳酸氢钠是个“小白脸”(白色细小的晶体),它很容易“生气”(与酸反应,产气速度快而多,还节省酸的用量!这一点比碳酸钠要优秀!用途是灭火剂:泡沫灭火剂。)
它喜“冷”而怕“热”(溶解时吸热,温度降低,与稀盐酸反应也吸热,固体加热就分解了,用作干粉灭火剂、)
注:碳酸钠固体溶于是放热的,碳酸氢钠固体溶于水是吸热的。
它比较“温柔”(碱性比纯碱弱,可作胃药、发酵剂)
它还有点“古怪”(若不了解它的脾气,我们会经常犯错!)
一、碳酸氢钠溶液中的平衡
查阅或计算5个平衡的平衡常数,发现平衡⑤的常数远远大于其他平衡常数,它的特殊性质与平衡⑤有极大的关系。要特别关注为HCO3-的自偶电离平衡。
二、碳酸氢钠溶液pH基本不变
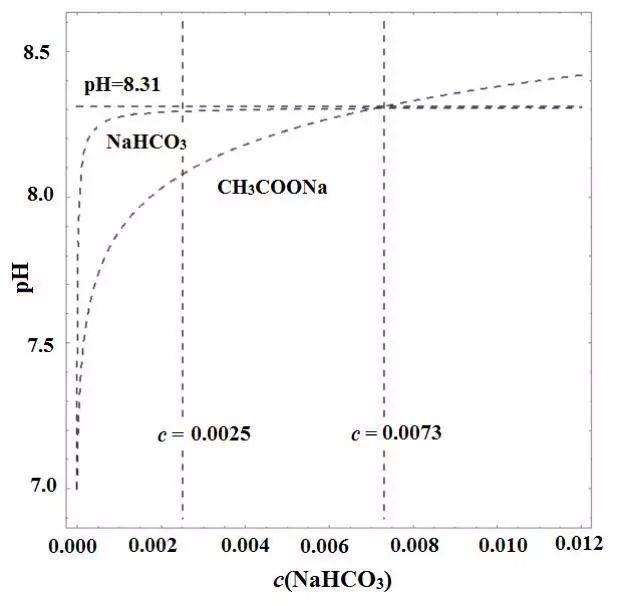
同温同浓度下CH3COONa溶液和NaHCO3溶液碱性强弱的比较。大多数老师依据越弱越水解得出“相同浓度的NaHCO3溶液碱性更强”的结论。但从图中看出,当c(NaHCO3)>0.0025mol·L-1时,其溶液的pH基本不变,当c>0.0073mol·L-1时,CH3COONa反而比NaHCO3溶液的碱性强。这主要与它是酸式盐有很大的关系,建议回避弱酸强碱盐与二元弱酸酸式强碱盐溶液的pH大小的比较。
三、如何比较碳酸氢钠溶液各粒子大小
从表中看到,无论NaHCO3溶液的浓度多大,c(OH-)>c(H+)与c(Na+)>c(HCO3-)>c(H2CO3)>c(CO32-)关系恒成立,至于其它粒子的浓度变化很大。鉴于二元弱酸酸式强碱盐溶液中离子行为的复杂性,建议回避比较NaHCO3、NaHSO3等溶液中各种离子浓度大小等问题。
四、CaCl2溶液能鉴别Na2CO3溶液与NaHCO3溶液
在中学化学教学中,一般认为CaCl2溶液与NaHCO3溶液不能发生化学反应,而CaCl2溶液与Na2CO3溶液可以发生反应,生成白色沉淀,因此CaCl2溶液可以用来鉴别Na2CO3溶液和NaHCO3溶液。但也有化学教师通过实验证明NaHCO3溶液也能与CaCl2溶液反应生成CaCO3白色沉淀,因而认为该鉴别方法不可行。
实验结果及理论计算均表明:只要待测样品中溶质含量在通常的鉴别范围内(>1%),用CaCl2溶液鉴别Na2CO3和NaHCO3溶液是完全可行的。
可推测CaCl2溶液与NaHCO3溶液混合时发生如下化学反应:CaCl2+2NaHCO3=CaCO3↓+H2O+CO2↑+2NaCl。这个方程与HCO3-的自偶电离有关。
当CaCl2溶液浓度和NaHCO3溶液浓度都小于0.1 mol·L-1时,可能是因为产生的CO2气体量较少,观察不到气泡。
五、NaHCO3溶液常温会分解
众所周知,碳酸氢钠固体受热易分解,通过实验与理论计算都可以推出NaHCO3溶液在常温下或加热时会分解成碳酸钠、水、二氧化碳。NaHCO3的分解在溶液中存在反应:
2HCO3-==CO32-+H2O+CO2↑。
而不是促进水解变成NaOH与H2CO3, H2CO3再分解成CO2气体,这是由于CO2气体不可能从NaOH溶液中逸出。
六、碳酸氢钠参与的反应
1、H2O+NaAlO2+NaHCO3=Al(OH)3↓+Na2CO3
2、AlCl3+3NaHCO3= 3CO2↑+ Al(OH)3↓+3NaCl
3、FeSO4+2NaHCO3=FeCO3↓+CO2↑+Na2SO4+H2O
可换成碳酸氢铵:FeSO4+2NH4HCO3=FeCO3↓+CO2↑+(NH4)2SO4+H2O
4、2Mg+2NaHCO3+2H2O=Mg(OH)2• MgCO3↓+Na2CO3+2H2↑
Mg在NaHCO3溶液中迅速反应,有H2和白色不溶物产生。
5、碳酸氢钠过量Ca(OH)2+2NaHCO3=CaCO3↓+Na2CO3+2H2O
碳酸氢钠少量:Ca(OH)2+NaHCO3=CaCO3↓+NaOH+H2O
七、碳酸氢钠生成的反应
1、NaCl(饱和)+NH3+H2O+CO2=NH4Cl+NaHCO3↓
2、NaClO+CO2+H2O=NaHCO3+HClO
3、C6H5ONa+CO2+H2O→C6H5OH(混浊)+NaHCO3
4、Na2CO3(饱和)+H2O+CO2=2NaHCO3↓
5、在饱和碳酸钠溶液中加入稀盐酸,边加入边搅拌,最初无气体产生,溶液变浑浊:
Na2CO3+HCl稀=NaHCO3↓+NaCl;继续滴入稀盐酸有气体,溶液变澄清。

- 全部评论(0)
