概念辨析:泡利不相容原理及洪特规则
时间:2023-01-02 15:56 来源:未知 作者:化学自习室 点击:次 所属专题: 洪特规则
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
能量最低原则:
在构建基态原子时,电子将尽可能地占领能量最低的原子轨道,使整个原子的能量最低。
泡利不相容原理(Pauli exclusion principle):
又称泡利原理,不相容原理,是微观粒子运动的基本规律之一。
内容是:在一个原子轨道里,不能有两个或两个以上的粒子处于完全相同的状态。确定的一个原子轨道上最多可容纳两个电子,而这两个电子的自旋方向必须相反。
核外电子除了要以接近光速绕原子核高速运动外,还像地球一样绕自己的轴自旋。自旋是电子的内在属性。且自旋只有顺时针和逆时针两种方向。常用上下箭头( ⬆️ 和 ⬇️ )表示自旋相反的电子。
洪特规则 (Hund rule)
洪特规则前提:对于基态原子来说。
内容:
1. 在等价轨道(指相同电子层、电子亚层上的各个轨道)上排布的电子将尽可能分占不同的轨道,且自旋方向相同
2. 在同一个电子亚层中排布的电子,总是尽先占据不同的轨道,且自旋方向相同
3.当同一能级各个轨道上的电子排布为全满、半满或全空时,可使体系能量最低。比如:
24号元素铬(Cr)电子排布为 1s22s22p63s23p63d54s1
29号元素铜(Cu)电子排布为 1s22s22p63s23p63d104s1
泡利原理和洪特规则看似很复杂,实际并不是,它们是为了解释电子到底是按照什么逻辑填入原子轨道服务的。
泡利原理核心思想:
1.一个原子轨道里,最多 2 电子
2.如果一个原子轨道里只有 1 个电子,自旋方向爱顺时针和逆时针都行,但如果有 2 个,只能一个顺时针、一个逆时针方向。
比如:(3、4、5号元素原子 Li 、Be 、B 的电子排布轨道)

洪特规则核心思想:
1.电子不是完全填完一个轨道再去另一个轨道,它倾向于多吃多占
2.电子多吃多占的时候也不是没有章法,它用平行自旋的方式占领,这样是为了让原子能量降低。
比如:第 2 层的 4 个电子排布逻辑:
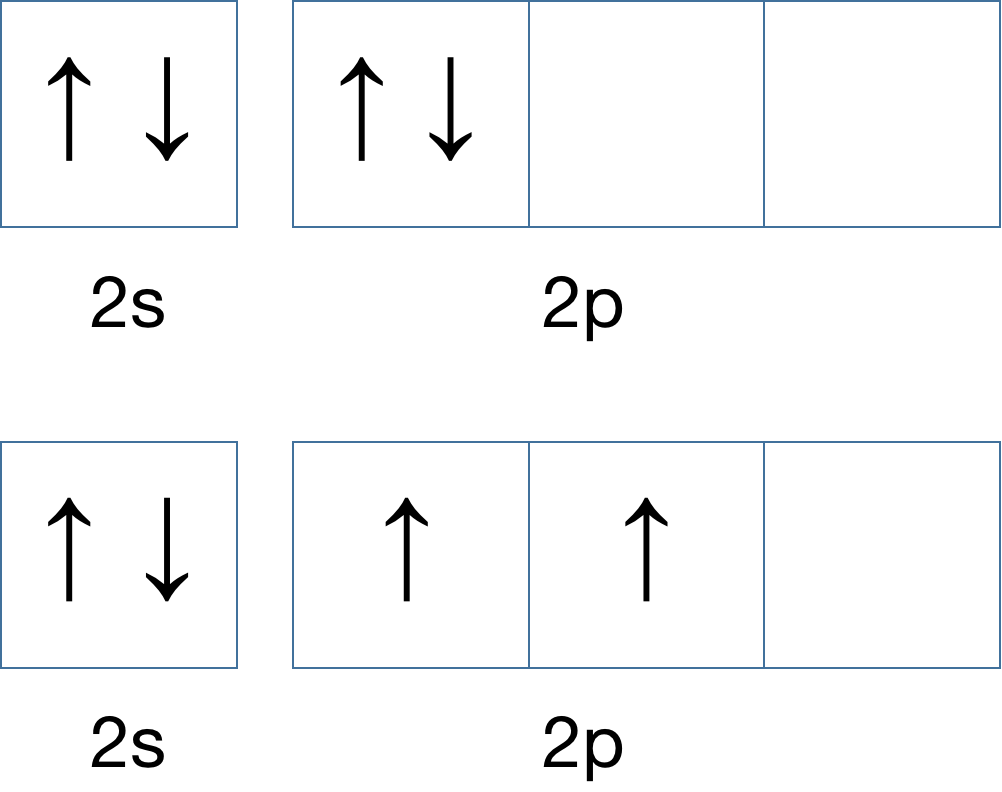
正确的是下方的排布轨道,电子会先填充完 2s 轨道,一共 2 个,然后剩下的 2 个电子去填充 2p 轨道,2p 的轨道能量相同,这个时候电子会多吃多占,倾向于占领更过轨道,但是注意,2p 轨道里的电子自旋方向相同。那么,如果再增加一个电子,轨道排布会如何?
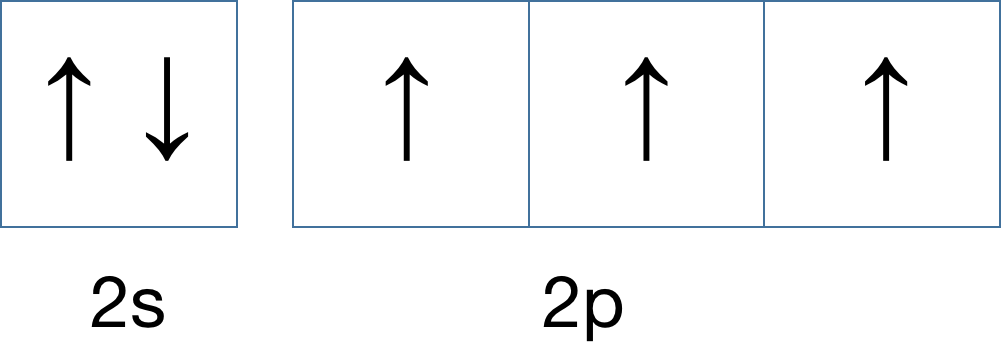
如果,再增加一个呢?
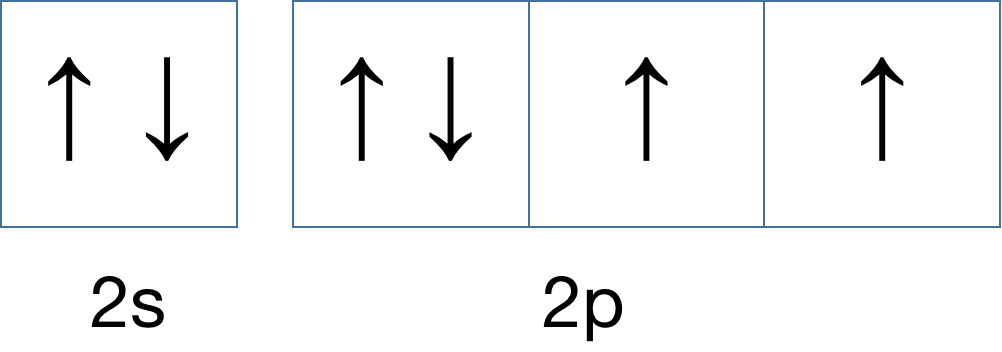
以上,就是对泡利原理和洪特规则的解释。

- 全部评论(0)
