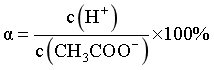福建省2022年高考化学试题
时间:2023-12-18 09:34 来源:未知 作者:化学自习室 点击:次 所属专题: 新高考题库
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
福建省2022年高考化学试题
【2022福建等级考】1. 福建多个科研机构经过长期联合研究发现,使用C60和改性的Cu基催化剂,可打通从合成气经草酸二甲酯常压催化加氢制备乙二醇的技术难关。下列说法正确的是
A. 草酸属于无机物
B. C60与石墨互为同分异构体
C. Cu属于过渡元素
D. 催化剂通过降低焓变加快反应速率
【答案】C
【解析】
【详解】A.草酸属于二元弱酸,即乙二酸,属于有机物,A错误;
B.C60与石墨是碳元素的不同单质,互为同素异形体,B错误;
C.Cu为ⅠB族,属于过渡元素,C正确;
D.催化剂通过降低反应的活化能加快反应速率,反应焓变不变,D错误;
故选C。
【2022福建等级考】2. 络塞维是中药玫瑰红景天中含有的一种天然产物,分子结构见下图。关于该化合物下列说法正确的是
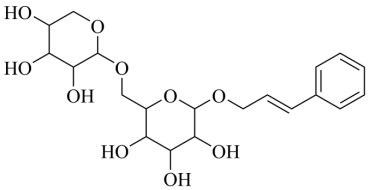
A. 不能发生消去反应
B. 能与醋酸发生酯化反应
C. 所有原子都处于同一平面
D. 1 mol络塞维最多能与3mol H2反应
【答案】B
【解析】
【详解】A.该化合物的分子中,与羟基相连的碳原子的邻位碳原子上有氢原子,可发生消去反应,A错误;
B.该化合物含有羟基,可与醋酸发生酯化反应,B正确;
C.该化合物的结构中含有饱和碳原子,不可能所有原子处于同一平面上,C错误;
D.1 mol络塞维最多能与4 mol H2反应,其中苯环消耗3mol H2,碳碳双键消耗1mol H2,D错误;
故选B。
【2022福建等级考】3. 常温常压下,电化学还原制氨气的总反应方程式: ,设NA为阿伏加德罗常数的值,下列说法正确的是
,设NA为阿伏加德罗常数的值,下列说法正确的是
A. 9g水中含有的孤电子对数为2NA
B. 每产生34g NH3 ,N2失去的电子数为6NA
C. 1 mol/L氨水中,含有的NH3·H2O分子数少于NA
D. 消耗11.2L N2(己折算为标况)时,产生的O2分子数为0.75NA
【答案】D
【解析】
【详解】A.H2O分子中孤电子对数为![]() =2,9gH2O的物质的量为
=2,9gH2O的物质的量为![]() =0.5mol,含有的孤电子对数为NA,故A错误;
=0.5mol,含有的孤电子对数为NA,故A错误;
B.该反应中N2中N元素化合价由0价下降到-3价,34g NH3的物质的量为![]() =2mol,每产生34g NH3,N2得到6mol电子,数目为6NA,故B错误;
=2mol,每产生34g NH3,N2得到6mol电子,数目为6NA,故B错误;
C.氨水的体积未知,无法计算NH3·H2O的分子数,故C错误;
D.11.2L N2的物质的量为0.5mol,由方程式可知,消耗0.5mol N2,产生的0.75mol O2,数目为0.75NA,故D正确;
故选D。
【2022福建等级考】4. 某非线性光学晶体由钾元素(K)和原子序数依次增大的X、Y、Z、W四种短周期元素组成。X与Y、Z与W均为同周期相邻元素,X的核外电子总数为最外层电子数的2倍,Z为地壳中含量最多的元素。下列说法正确的是
A. 简单氢化物沸点:![]()
B. YW3分子的空间构型为三角锥形
C. 原子半径:![]()
D. 最高价氧化物对应水化物的碱性:![]()
【答案】A
【解析】
【分析】X的核外电子总数为最外层电子数的2倍,X为Be;Z为地壳中含量最多的元素,Z为O,X与Y、Z与W均为同周期相邻元素,Y为B,W为F,据此解答。
【详解】A.H2O常温下为液态,HF常温下为气体,沸点H2O>HF,故A正确;
B.YW3为BF3,中心B原子有3对价电子且没有孤电子对,空间构型为平面三角形,故B错误;
C.四种元素为同周期元素,随核电荷数增大原子半径减小,原子半径:Be>B>O>F,故C错误;
D.Be最高价氧化物水化物为Be(OH)2,溶液显两性,B最高价氧化物的水化物为H3BO3,溶液显酸性,故D错误;
故选:A。
【2022福建等级考】5. 探究醋酸浓度与电离度![]() 关系的步骤如下,与相关步骤对应的操作或叙述正确的
关系的步骤如下,与相关步骤对应的操作或叙述正确的
步骤 | 操作或叙述 | |
A | Ⅰ.用NaOH标准溶液标定醋酸溶液浓度 | 滴定时应始终注视滴定管中的液面 |
B | Ⅱ.用标定后的溶液配制不同浓度的醋酸溶液 | 应使用干燥的容量瓶 |
C | Ⅲ.测定步骤Ⅰ中所得溶液的pH | 应在相同温度下测定 |
D | Ⅳ.计算不同浓度溶液中醋酸的电离度 | 计算式为 |
A. A B. B C. C D. D
【答案】C
【解析】
【详解】A.中和滴定时眼睛应始终注视锥形瓶内溶液颜色的变化,A错误;
B.配制不同浓度的醋酸溶液时,容量瓶不需要干燥,B错误;
C.温度影响醋酸的电离平衡,因此测定步骤Ⅰ中所得溶液的pH时应在相同温度下测定,C正确;
D.电离度是指弱电解质在溶液里达电离平衡时,已电离的电解质分子数占原来总分子数(包括已电离的和未电离的)的百分数,因此醋酸的电离度计算式为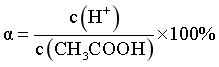 ,D错误;
,D错误;
答案选C。
【2022福建等级考】6. 用铬铁合金(含少量Ni、Co单质)生产硫酸铬的工艺流程如下:
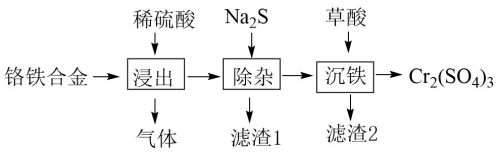
下列说法错误的是
A. “浸出”产生的气体含有H2
B. “除杂”的目的是除去Ni、Co元素
C. 流程中未产生六价铬化合物
D. “滤渣2”的主要成分是Fe2(C2O4)3
【答案】D
【解析】
【分析】由流程可知,加入稀硫酸溶解,生成气体为氢气,溶液中含Ni2+、Co2+、Cr3+、Fe2+加入Na2S分离出滤渣1含CoS和NiS,Cr3+、Fe2+不会沉淀,再加入草酸除铁生成FeC2O4,过滤分离出硫酸铬,以此来解答。
![]() 详解】A.四种金属均与稀硫酸反应生成H2,A正确;
详解】A.四种金属均与稀硫酸反应生成H2,A正确;
B.共有四种金属,由流程可知,沉铁后分离出硫酸铬,则“除杂"的目的是除去Ni、Co元素,B正确;
C.由上述分析可知,流程中未产生六价铬化合物,C正确;
D.“滤渣2”的主要成分是FeC2O4,D错误;
故本题选D。
【2022福建等级考】7. 锂辉石是锂的重要来源,其焙烧后的酸性浸出液中含有Fe3+、Al3+、Fe2+和Mg2+杂质离子,可在0~14范围内调节pH对其净化(即相关离子浓度![]() )。25℃时,
)。25℃时,![]() 与pH关系见下图(碱性过强时Fe(OH)3和Fe(OH)2会部分溶解)。下列说法正确的是
与pH关系见下图(碱性过强时Fe(OH)3和Fe(OH)2会部分溶解)。下列说法正确的是
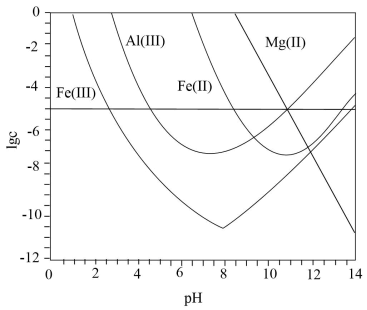
A. Mg2+可被净化的pH区间最大
B. 加入适量H2O2,可进一步提升净化程度
C. 净化的先后顺序:Mg2+、Fe2+、Fe3+、Al3+
D. ![]()
【答案】B
【解析】
【详解】A.对离子净化时,相关离子浓度c<10-5mol/L,则lgc<-5,由图可知,可作净化的pH区间最大的是Fe3+,A错误;
B.加入适量H2O2,可将Fe2+氧化为Fe3+,提高净化程度,B正确;
C.由图可知,净化的先后顺序为Fe3+、Al3+、Fe2+、Mg2+,C错误;
D.对离子净化时,相关离子浓度c<10-5mol/L,lgc<-5,,由图可知,Fe3+完全沉淀的pH约为2.5,c(H+)=10-2.5mol/L,c(OH-)=10-11.5mol/L,![]() ,Al3+完全沉淀的pH约为4.5,c(H+)=10-4.5mol/L,c(OH-)=10-9.5mol/L,
,Al3+完全沉淀的pH约为4.5,c(H+)=10-4.5mol/L,c(OH-)=10-9.5mol/L,![]() ,Fe2+完全沉淀的pH约为8.5,c(H+)=10-8.5mol/L,c(OH-)=10-5.5mol/L,
,Fe2+完全沉淀的pH约为8.5,c(H+)=10-8.5mol/L,c(OH-)=10-5.5mol/L,![]() ,则有
,则有![]() ,D错误;
,D错误;
故选B。
【2022福建等级考】8. 实验室需对少量污染物进行处理。以下处理方法和对应的反应方程式均错误的是
A. 用硫磺处理洒落在地上的水银:S+Hg = HgS
B. 用盐酸处理银镜反应后试管内壁的金属银:2Ag+2H+=2Ag++H2↑
C. 用烧碱溶液吸收蔗糖与浓硫酸反应产生的刺激性气体:SO3+2OH-=SO42-+H2O
D. 用烧碱溶液吸收电解饱和食盐水时阳极产生的气体:Cl2+2OH-=Cl-+ClO-+H2O
【答案】B
【解析】
【详解】A.S和Hg发生化合反应生成HgS,可以用硫磺处理洒落在地上的水银,方程式为:S+Hg=HgS,故A正确;
B.Ag不活泼,不能和盐酸反应生成氢气,故B错误;
C.蔗糖与浓硫酸反应产生的刺激性气体为SO2,可以用NaOH溶液吸收SO2,离子方程式为:SO3+2OH-=SO42-+H2O,故C正确;
D.电解饱和食盐水时阳极产生的气体为Cl2,可以用NaOH溶液吸收Cl2,离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,故D正确;
故选B。
【2022福建等级考】9. 一种化学“自充电”的锌-有机物电池,电解质为KOH和Zn(CH3COO)2水溶液。将电池暴露于空气中,某电极无需外接电源即能实现化学自充电,该电极充放电原理如下图所示。下列说法正确的是
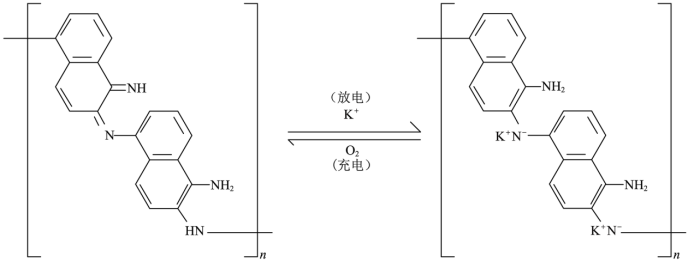
A. 化学自充电时,c(OH-)增大
B. 化学自充电时,电能转化为化学能
C. 化学自充电时,锌电极反应式:Zn2++2e-=Zn
D. 放电时,外电路通过0.02mol电子,正极材料损耗0.78 g
【答案】A
【解析】
【详解】A.由图可知,化学自充电时,消耗O2,该反应为O2+2H2O+4e-=4OH-,c(OH-)增大,故A正确;
B.化学自充电时,无需外接电源即能实现化学自充电,该过程不是电能转化为化学能,故B错误;
C.由图可知,化学自充电时,锌电极作阴极,该电极的电极反应式为O2+2H2O+4e-=4OH-,故C错误;
D.放电时,1mol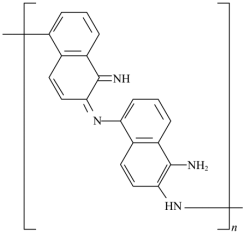 转化为
转化为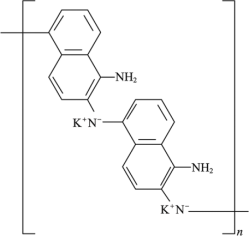 ,消耗2molK+,外电路通过0.02mol电子时,正极物质增加0.02mol K+,增加的质量为0.02mol×39g/mol =0.78g,故D错误;
,消耗2molK+,外电路通过0.02mol电子时,正极物质增加0.02mol K+,增加的质量为0.02mol×39g/mol =0.78g,故D错误;
故选A。
【2022福建等级考】10. 氨氢是水体污染物的主要成分之一,工业上可用次氯酸盐作处理剂,有关反应可表示为:
①![]()
②![]()
在一定条件下模拟处理氨氮废水:将1L 0.006mol/L的氨水分别和不同量的NaClO混合,测得溶液中氨去除率、总氮(氨氮和硝氮的总和)残余率与NaClO投入量(用x表示)的关系如下图所示。下列说法正确的是
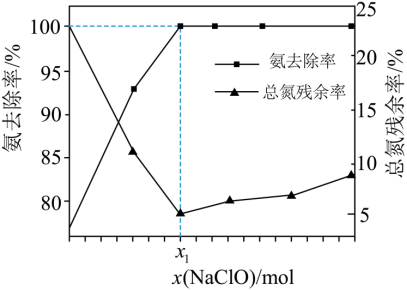
A. x1的数值为0.009
B. x>x1时,c(Cl-)=4c(NO3-)
C. x>x1时,x越大,生成N2的量越少
D. x=x1时,![]()
【答案】C
【解析】
【详解】A.x1时,氨的去除率为100%、总氮残留率为5![]() ,
,![]() ,95%的氨气参与反应①、有5%的氨气参与反应②,反应①消耗
,95%的氨气参与反应①、有5%的氨气参与反应②,反应①消耗![]() ,参与反应②消耗
,参与反应②消耗![]() ,
,![]() ,A错误;
,A错误;
B.x>x1时,反应①也生成氯离子,所以c(Cl-)>4c(NO3-),B错误;
C.x>x1时,x越大,氨总去除率不变,氮残余率增大,说明生成的硝酸根离子越多,生成N2的量越少,C正确;
D.x=x1时,氨的去除率为100%,溶液中没有NH4+和ClO-,含有Na+、H+、NO3-、Cl-和OH-,根据电荷守恒得![]() ,D错误;
,D错误;
故本题选C。
【2022福建等级考】11. 粉煤灰是火电厂的大宗固废。以某电厂的粉煤灰为原料(主要含SiO2、Al2O3和CaO等)提铝的工艺流程如下:
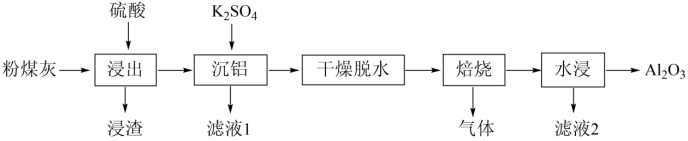
回答下列问题:
(1)“浸出”时适当升温的主要目的是_______,Al2O3发生反应的离子方程式为_______。
(2)“浸渣”的主要成分除残余Al2O3外,还有_______。实验测得,5.0g粉煤灰(Al2O3的质量分数为30%)经浸出、干燥后得到3.0 g“浸渣”(Al2O3的质量分数为8%),Al2O3的浸出率为_______。
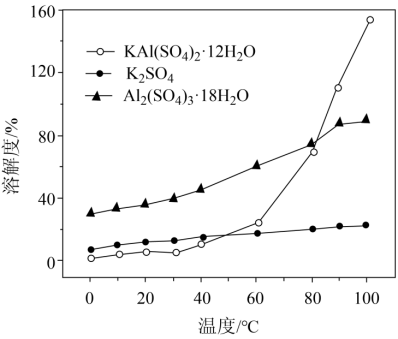
(3)“沉铝”时,体系中三种物质的溶解度曲线如下图所示,加入K2SO4沉铝的目的是_______,“沉铝”的最佳方案为_______。
(4)“焙烧”时,主要反应的化学方程式为_______。
(5)“水浸”后得到的“滤液2”可返回_______工序循环使用。
【答案】(1) ①. 提高浸出率(或提高浸出速率) ②. Al2O3+6H+=2Al3++3H2O
(2) ①. SiO2和CaSO4 ②. 84%
(3) ①. 使更多的铝元素转化为晶体析出,同时保证晶体纯度 ②. 高温溶解再冷却结晶
(4)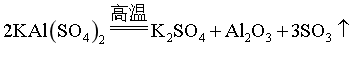 或
或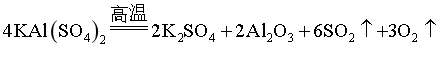
(5)沉铝
【解析】
【分析】粉煤灰为原料(主要含SiO2、Al2O3和CaO等)加入硫酸,浸渣为二氧化硅、硫酸钙,加入硫酸钾,产生复盐明矾沉铝,干燥脱水,焙烧产生氧化铝、硫酸钾和二氧化硫气体,水浸除去硫酸钾,得到氧化铝。
【小问1详解】
温度高速率大,“浸出”时适当升温的主要目的是提高反应速率,提高浸出率;Al2O3和H2SO4发生反应生成Al2(SO4)3和H2O,离子反应方程式为Al2O3+6H+=2Al3++3H2O;
故答案为:提高浸出率(或提高浸出速率);Al2O3+6H+=2Al3++3H2O。
【小问2详解】
“浸渣”的主要成分除残余Al2O3外,还有二氧化硅、硫酸钙;5.0g粉煤灰Al2O3的质量为5.0g×30%=1.5g,3.0g“浸渣”Al2O3的质量为3.0g×8%=0.24g,则Al2O3的浸出率为![]() ;
;
故答案为:SiO2和CaSO4;84%。
【小问3详解】
根据沉铝体系中,Al2(SO4)3·18H2O溶解度最大,KAl(SO4)2·12H2O溶解度最小,更容易析出,加入K2SO4沉铝的目的是更多的使Al2(SO4)3转化为KAl(SO4)2·12H2O,使更多的铝元素转化为晶体析出,同时保证晶体纯度;KAl(SO4)2·12H2O溶解度受温度影响较大,“沉铝”的最佳方案为高温溶解再冷却结晶;
故答案为:使更多的铝元素转化为晶体析出,同时保证晶体纯度;高温溶解再冷却结晶。
【小问4详解】
“焙烧”时,KAl(SO4)2分解为K2SO4、Al2O3和SO3或K2SO4、Al2O3、SO2和O2,反应方程式为2KAl(SO4)2 K2SO4+Al2O3+3SO3↑或4KAl(SO4)2
K2SO4+Al2O3+3SO3↑或4KAl(SO4)2 2K2SO4+2Al2O3+6SO2↑+3O2↑;
2K2SO4+2Al2O3+6SO2↑+3O2↑;
故答案为:2KAl(SO4)2 K2SO4+Al2O3+3SO3↑或4KAl(SO4)2
K2SO4+Al2O3+3SO3↑或4KAl(SO4)2 2K2SO4+2Al2O3+6SO2↑+3O2↑。
2K2SO4+2Al2O3+6SO2↑+3O2↑。
【小问5详解】
“水浸”后得到的“滤液2”成分为K2SO4,可在沉铝工序循环使用;
故答案为:沉铝。
【2022福建等级考】12. 某兴趣小组设计实验探究![]() ,催化空气氧化CO的效率。回答下列问题:
,催化空气氧化CO的效率。回答下列问题:
步骤Ⅰ 制备CO
在通风橱中用下图装置制备CO(加热及夹持装置省略),反应方程式:![]()
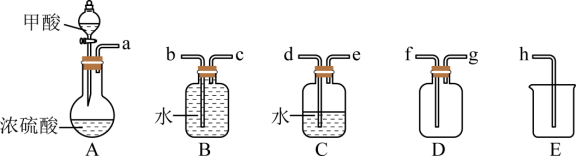
(1)装置A中盛放甲酸的仪器的名称是_______。
(2)从B、C、D中选择合造的装置收集CO,正确的接口连接顺序为a→_______→_______→_______→_______→h(每空填一个接口标号)。______
步骤Ⅱ 检验CO
将CO通入新制银氨溶液中,有黑色沉淀生成。
(3)该反应的化学方程式为_______。
步骤Ⅲ 探究![]() 催化空气氧化CO的效率
催化空气氧化CO的效率
将一定量CO与空气混合,得到CO体积分数为1%的气体样品。使用下图装置(部分加热及夹持装置省略),调节管式炉温度至120℃,按一定流速通入气体样品。(已知:I2O5是白色固体,易吸水潮解:![]() )
)
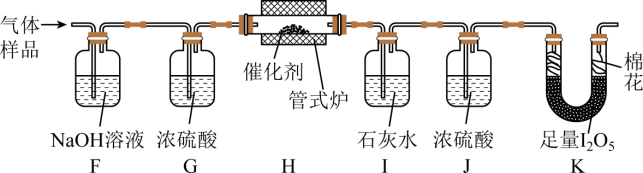
(4)通入11.2L(已折算为标况)的气体样品后,继续向装置内通入一段时间氮气,最终测得U形管内生成了0.1016g I2。
①能证明CO被空气氧化的现象是_______;
②CO被催化氧化的百分率为_______;
③若未通入氮气,②的结果将_______(填“偏大”“偏小”或“无影响”)。
(5)探究气体与催化剂接触时长对催化氧化效率的影响时,采用_______方法可以缩短接触时长。
(6)步骤Ⅲ装置存在的不足之处是_______。
【答案】(1)分液漏斗
(2)a→d→e→c→b
(3)![]()
(4) ①. 石灰水变浑浊 ②. 60% ③. 偏大
(5)增大气体样品流速
(6)尾气出口未加防潮装置(或其他相似表述)
【解析】
【分析】在通风橱中用下图装置制备一氧化碳,用A装置制取一氧化碳,该气体中含有甲酸蒸气,故用水除去甲酸,再用B装置排水收集一氧化碳气体,排出的水用E中的烧杯接收。根据气体样品通过氢氧化钠吸收空气中的二氧化碳,浓硫酸吸水,一氧化碳在H中被氧气氧化生成二氧化碳,二氧化碳能被石灰水吸收,J中的浓硫酸吸收气体中的水蒸气,干燥的一氧化碳和I2O5,进而测定生成的碘的质量,计算一氧化碳的被氧化的百分率。据此解答。
【小问1详解】
装置A中盛放甲酸的仪器为分液漏斗。
【小问2详解】
用C除去甲酸,B收集一氧化碳,E接收排出的水,故接口连接顺序为a→d→e→c→b→h。
【小问3详解】
一氧化碳和银氨溶液反应生成黑色的银,同时生成碳酸铵和氨气,方程式为:![]() 。
。
【小问4详解】
一氧化碳被氧气氧化生成二氧化碳,能使澄清的石灰水变浑浊。碘的物质的量为![]() ,则结合方程式分析,还有0.002mol一氧化碳未被氧气氧化,11.2L气体为0.5mol其中一氧化碳为0.005mol,则被氧化的一氧化碳为0.005-0.002=0.003mol,则被氧化的百分率为
,则结合方程式分析,还有0.002mol一氧化碳未被氧气氧化,11.2L气体为0.5mol其中一氧化碳为0.005mol,则被氧化的一氧化碳为0.005-0.002=0.003mol,则被氧化的百分率为![]() 。如果没有通入氮气则计算的未被氧化的一氧化碳的物质的量减少,则被氧化的百分率增大。
。如果没有通入氮气则计算的未被氧化的一氧化碳的物质的量减少,则被氧化的百分率增大。
【小问5详解】
增大气流速率可以提高催化效率。
【小问6详解】
:I2O5是白色固体,易吸水潮解,但该装置出气口未加防潮装置。
【2022福建等级考】13. 异丙醇(C3H8O)可由生物质转化得到,催化异丙醇脱水制取高值化学品丙烯(C3H6)的工业化技术已引起人们的关注,其主要反应如下:
Ⅰ.![]()
Ⅱ.![]()
回答下列问题:
(1)已知![]() ,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为_______。
,则C3H6(g)燃烧生成CO2(g)和H2O(g)的热化学方程式为_______。
(2)在1350℃下,刚性密闭容器中的反应体系内水蒸气浓度与反应时间关系如下表:
反应时间 | 0 | 4 | 8 | 12 | t | 20 |
| 0 | 2440 | 3200 | 3600 | 4000 | 4100 |
①![]() 内,
内,![]() _______
_______![]() ;
;
②t_______16(填“>”“<”或“=”)![]()
(3)在恒温刚性密闭容器中,反应Ⅰ、Ⅱ均达到平衡的判据是_______(填标号)。
a.H2O(g)的分压不变 b.混合气体密度不变
c.![]() d.
d.![]()
(4)在一定条件下,若反应Ⅰ、Ⅱ的转化率分别为98%和40%,则丙烯的产率为_______。
(5)下图为反应Ⅰ、Ⅱ达到平衡时![]() 与温度的关系曲线。
与温度的关系曲线。
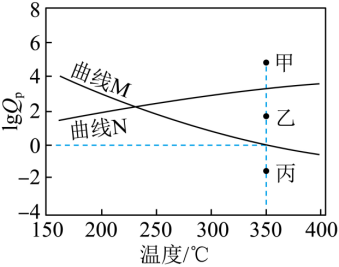
(已知:对于可逆反应aA(g)+bB(g) cC(g)+dD(g),任意时刻
cC(g)+dD(g),任意时刻![]() ,式中
,式中![]() )表示物质×的分压)
)表示物质×的分压)
①在350℃恒压平衡体系中充入少量水蒸气时,反应Ⅰ的的状态最有可能对应图中的_______点(填“甲”“乙”或“丙”),判断依据是_______。
②350℃时,在密闭容器中加入一定量的C3H8O,体系达到平衡后,测得C6H12的分压为x MPa,则水蒸气的分压为_______MPa(用含x的代数式表示)。
【答案】(1)![]()
(2) ①. 190 ②. >
(3)ad(4)58.8%
(5) ①. 甲 ②. 反应I平衡曲线为N,恒压时充入水蒸气,![]() ③.
③. ![]()
【解析】
【小问1详解】
设Ⅲ ![]() ,根据盖斯定律Ⅲ-2×Ⅰ得
,根据盖斯定律Ⅲ-2×Ⅰ得![]() 。
。
【小问2详解】
①![]() 内,
内,![]() ,则
,则![]() ;
;
②![]() 、
、![]() 、
、![]() ,△c(H2O)逐渐减小,说明反应速率减小,
,△c(H2O)逐渐减小,说明反应速率减小,![]() 内,Δc(H2O)=400ppm,
内,Δc(H2O)=400ppm,![]() 内,Δc(H2O)=400ppm,则t-12>4,即t>16。
内,Δc(H2O)=400ppm,则t-12>4,即t>16。
【小问3详解】
a.H2O的分压不变,则C3H6的分压也不变,反应1、Ⅱ各组分分压不变,反应1、Ⅱ均达到平衡,a正确;
b.反应物和生成物均为气体,混合气体![]() 总质量不变,刚性密闭容器体积不变,则混合气体密度不变,不能作为反应I、Ⅱ均达到平衡的判据,b错误;
总质量不变,刚性密闭容器体积不变,则混合气体密度不变,不能作为反应I、Ⅱ均达到平衡的判据,b错误;
c.当![]() 时,反应不一定达到平衡,不能作为反应1、Ⅱ均达到平衡的判据,c错误;
时,反应不一定达到平衡,不能作为反应1、Ⅱ均达到平衡的判据,c错误;
d.![]() ,说明正逆反应速率相等,反应I达平衡,各组分分压不变,C3H6的分压不变,说明反应Ⅱ也达平衡,d正确;
,说明正逆反应速率相等,反应I达平衡,各组分分压不变,C3H6的分压不变,说明反应Ⅱ也达平衡,d正确;
故选ad。
【小问4详解】
设C3H8O的物质的量为1mol,若lmol C3H8O完全反应,理论上生成1mol C3H6,因为反应Ⅰ、Ⅱ的转化率分别为98%和40%,反应I生成1mol×98%=0.98mol C3H6,反应Ⅱ消耗了40% C3H6,则达平衡时C3H6的物质的量为0.98mol×(1-40%)=0.588mol,所以丙烯的产率为![]() =58.8%。
=58.8%。
【小问5详解】
①反应I为气体体积增大的吸热反应,反应Ⅱ为气体体积减小的放热反应,则升高温度,反应I正向移动,![]() 逐渐增大,反应Ⅱ逆向移动,
逐渐增大,反应Ⅱ逆向移动,![]() 逐渐减小,即反应I为平衡曲线为N,反应Ⅱ平衡曲线为M;在350℃恒压平衡体系中充入少量水蒸气时,对于反应I而言,相当于增大生成物浓度,使得
逐渐减小,即反应I为平衡曲线为N,反应Ⅱ平衡曲线为M;在350℃恒压平衡体系中充入少量水蒸气时,对于反应I而言,相当于增大生成物浓度,使得![]() >
>![]() ,即lg
,即lg![]() 增大,反应I的状态最有可能对应图中的甲;
增大,反应I的状态最有可能对应图中的甲;
②由图可知,350°C时达平衡后,![]() =0,则350℃时
=0,则350℃时![]() =
=![]() =1,设水蒸气的平衡分压为a MPa,则反应II的C3H6起始分压为 a MPa,对反应Ⅱ列三段式有
=1,设水蒸气的平衡分压为a MPa,则反应II的C3H6起始分压为 a MPa,对反应Ⅱ列三段式有
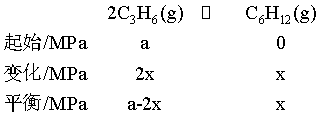
![]() ,解得a=
,解得a=![]() MPa。
MPa。
【2022福建等级考】14. 1962年首个稀有气体化合物XePtF6问世,目前已知的稀有气体化合物中,含氩(54Xe)的最多,氪 (36Kr)次之,氩(18Ar)化合物极少。![]() 是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,其晶胞如下图所示。
是[BrOF2]+、[AsF6]-与KrF2分子形成的加合物,其晶胞如下图所示。
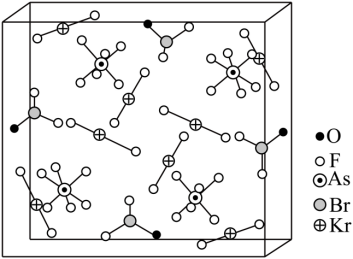
回答下列问题:
(1)基态As原子的价电子排布式为_______。
(2)Ar、Kr、Xe原子的活泼性依序增强,原因是_______。
(3)晶体熔点:KrF2_______XeF2(填“>”“<”或“=”),判断依据是_______。
(4)[BrOF2]+的中心原子Br的杂化轨道类型为_______。
(5)![]() 加合物中x=_______,晶体中的微粒间作用力有_____(填标号)。
加合物中x=_______,晶体中的微粒间作用力有_____(填标号)。
a.氢健 b.离子健 c.极性共价键 d.非极性共价键
【答案】(1)4s24p3
(2)同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强
(3) ①. < ②. 二者为同构型的分子晶体,XeF2相对分子质量大,范德华力大,熔点高
(4)![]()
(5) ①. 2 ②. bc
【解析】
【小问1详解】
![]() 位于元素周期表中第四周期VA族,原子序数为33,由构造原理写出其价电子排布式为4s24p3。
位于元素周期表中第四周期VA族,原子序数为33,由构造原理写出其价电子排布式为4s24p3。
【小问2详解】
同族元素,从上而下原子半径逐渐增大,原子核对外层电子的有效吸引逐渐减弱,失电子能力逐渐增强,故Ar、Kr、Xe原子的活泼性依序增强。
【小问3详解】
KrF2和XeF2是同构型的分子晶体,XeF2相对分子质量大,范德华力大,熔点高,晶体熔点:KrF2<XeF2。
【小问4详解】
[BrOF2]+的中心原子Br的价层电子对数为:3+![]() =4,杂化轨道类型为sp3。
=4,杂化轨道类型为sp3。
【小问5详解】
由晶胞结构可知,其中含有6个KrF2,则![]() 加合物中
加合物中![]() 6,晶体中的微粒间作用力有离子健、极性共价键,故选bc。
6,晶体中的微粒间作用力有离子健、极性共价键,故选bc。
【2022福建等级考】15. 3-氧代异紫杉二酮是从台湾杉中提取的具有抗痛活性的天然产物。最近科学家完成了该物质的全合成,其关键中间体(F)的合成路线如下:
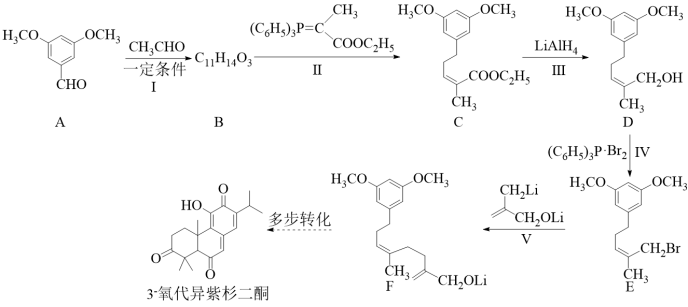
已知: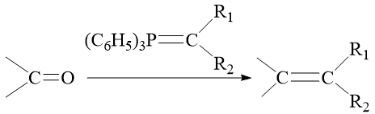
回答下列问题:
(1)A的含氧官能团有醛基和_______。
(2)B的结构简式为_______。
(3)Ⅳ的反应类型为_______;由D转化为E不能使用HBr的原因是_______。
(4)反应Ⅴ的化学方程式为_______。
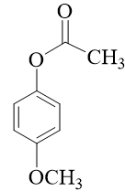
(5)化合物Y是A的同分异构体,同时满足下述条件:
①Y的核磁共振氢谱有4组峰,峰而积之比为![]() 。
。
②Y在稀硫酸条件下水解,其产物之一(分子式为C7H8O2)遇FeCl3溶液显紫色。则Y的结构简式为_______。
【答案】(1)醚键(或醚基)
(2) (3) ①. 取代反应 ②. HBr会与碳碳双键发生加成反应(或HBr会使醚键水解)
(3) ①. 取代反应 ②. HBr会与碳碳双键发生加成反应(或HBr会使醚键水解)
(4) (5)
(5)
【解析】
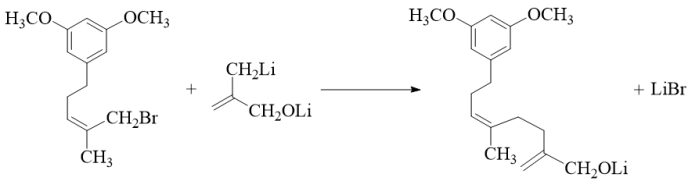
【分析】有机合成可从正向和逆向共同进行推断,根据已知信息由C可推出B为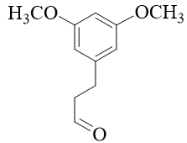 ,根据C到D的结构变化可知此步酯基发生水解反应,根据D到E的结构可知此步Br取代了羟基,根据E到F的结构可知脱去LiBr,为取代反应,据此进行推断。
,根据C到D的结构变化可知此步酯基发生水解反应,根据D到E的结构可知此步Br取代了羟基,根据E到F的结构可知脱去LiBr,为取代反应,据此进行推断。
【小问1详解】
A的含氧官能团有醛基和醚键。
【小问2详解】
根据分析可知,B的结构简式为 。
。
【小问3详解】
反应Ⅳ中Br取代了羟基,为取代反应,此反应不用HBr的原因为HBr会与碳碳双键发生加成反应(或HBr会使醚键水解)。
【小问4详解】
反应Ⅴ的化学方程式为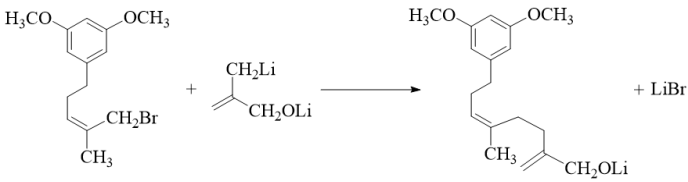 。
。
【小问5详解】
产物之一(分子式为C7H8O2)遇FeCl3溶液显紫色,说明含有酚羟基,酚羟基是通过酯基水解得来的,又因为核磁共振氢谱有4组峰,峰而积之比为![]() ,说明Y有两个甲基,综合可知Y的结构简式为
,说明Y有两个甲基,综合可知Y的结构简式为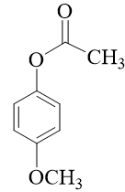 。
。

- 全部评论(0)