晨读笔记:无机非金属材料
时间:2023-08-09 20:07 来源:未知 作者:化学自习室 点击: 次 所属专题: 无机非金属材料
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.硅在地壳中的含量仅次于氧,为26.3%。
02.硅是一种亲氧元素,在自然界仅以化合态的形式存在,主要以硅酸盐和氧化物的形式存在。
03.晶体硅是一种带有金属光泽的灰黑色固体,晶体硅熔点高、硬度大、有脆性。
04.晶体硅导电性介于导体和绝缘体之间,是良好的半导体材料,用于芯片和太阳能电池。
05.硅的原子最外层有4个电子,反应中既不容易得到电子,也不容易失去电子。
06.常温下,硅的化学性质不活泼,只与F2、HF(氢氟酸)、强碱(如NaOH)溶液反应。
07.硅与氟气反应:Si+2F2===SiF4
08.硅与氢氟酸反应:Si+4HF===SiF4↑+2H2↑
09.硅与NaOH溶液反应:Si+2NaOH+H2O===Na2SiO3+2H2↑,该反应中,还原剂是硅,氧化剂是水,该反应可理解为分三步进行。
首先,硅与水反应生成H4SiO4(原硅酸)和H2:Si+4H2O===H4SiO4+2H2↑;(氧化还原的本质)
其次,H4SiO4(原硅酸)失水生成H2SiO3(硅酸) H4SiO4==H2SiO3+H2O;
最后,H2SiO3与NaOH反应:H2SiO3+2NaOH===Na2SiO3+2H2O。
14.若需要标明电子转移的方向和数目时应写成:Si+2NaOH+4H2O===Na2SiO3+2H2↑+3H2O
15.加热和高温时,硅能与O2、Cl2、C等反应
①与O2反应:Si+O2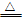 SiO2
SiO2
②与Cl2反应:Si+2Cl2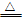 SiCl4
SiCl4
③与C反应:Si+C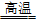 SiC
SiC
19.硅在自然界中以化合态存在,工业上常以二氧化硅为原料来制取单质硅。
20.制备方法1:
①SiO2+2C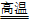 Si(粗)+2CO↑,
Si(粗)+2CO↑,
②Si(粗)+3HCl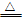 SiHCl3+H2,
SiHCl3+H2,
③SiHCl3+H2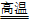 Si(纯)+3HCl
Si(纯)+3HCl
21.制备方法2:
①SiO2+2C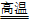 Si(粗)+2CO↑,
Si(粗)+2CO↑,
②Si(粗)+2Cl2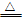 SiCl4,
SiCl4,
③SiCl4+2H2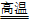 Si(纯)+4HCl
Si(纯)+4HCl
22.粗硅制备时,要隔绝空气,在电炉中进行,且生成的是CO而不是CO2。
23.粗硅中含碳等杂质,与氯气反应生成的SiCl4中也含有CCl4等杂质,经过分馏提纯SiCl4后,再用H2还原,得到高纯度的硅。
24.Si的还原性大于C,但C却能在高温下还原出Si,不能用粗硅制备的反应来判断还原性强弱。
25.SiO2广泛存在于自然界中,SiO2的存在形式有结晶形和无定形两大类,水晶、玛瑙的主要成分是结晶的二氧化硅,沙子、石英的主要成分就是二氧化硅。
26.SiO2不溶于水,熔点高,硬度大,是典型的原子晶体(共价晶体)。
27.二氧化硅晶体是原子晶体,是由硅原子和氧原子构成的,硅原子和氧原于的个数比为1:2
28.二氧化硅晶体中Si原子与Si—O键的比为1:4,即1mol SiO2晶体中含4NA个Si—O共价键。
29.二氧化硅具有酸性氧化物的通性:SiO2是酸性氧化物,是硅酸的酸酐,但难溶于于水。
30.SiO2与NaOH溶液反应:SiO2+2NaOH===Na2SiO3+H2O
31.SiO2与碱性氧化物反应:SiO2+CaO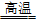 CaSiO3
CaSiO3
32.SiO2有弱氧化性:SiO2+2C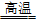 Si+2CO↑
Si+2CO↑
33.SiO2能与氢氟酸(HF)反应:SiO2+4HF===SiF4↑+2H2O (用氢氟酸刻蚀玻璃)
34.盛装NaOH、Na2CO3等碱性溶液的玻璃试剂瓶应该用橡胶塞,而不能用磨口玻璃塞,NaOH及Na2CO3水解产生的NaOH都会和磨口处的SiO2发生反应,生成Na2SiO3,而Na2SiO3具有良好的粘性,会将瓶塞与瓶口在磨口处粘接在一起。
34.玻璃试剂瓶经烧结处理后,表面光滑,所含的SiO2相对较少,故我们可以用玻璃瓶盛装NaOH等碱性溶液。
35.盛装硅酸钠溶液的试剂瓶也不能用玻璃塞(硅酸钠是一种矿物胶,粘性大)。
36.氢氟酸可较快腐蚀玻璃,可用氢氟酸刻蚀玻璃,应保存氢氟酸而应用塑料瓶或铅皿中。
37.石英坩埚不能熔融氢氧化钠等碱性固体,可用铁坩埚或铂金坩埚来熔融氢氧化钠。
38.SiO2是用于制备粗硅的重要原料,制得的粗硅会含有杂质,需要进一步提纯;
39.纯净的SiO2是现代光学及光纤制品的基本原料,可以制作光导纤维;
40.石英和玛瑙制作饰物和工艺品,SiO2用于制造各种玻璃制品,实验室中使用耐高温石英坩埚
41.硅酸(H2SiO3) 是白色胶状沉淀, 是高中阶段唯一不溶于水的酸。
42.硅酸酸性比碳酸的酸性弱,硅酸不能使紫色石蕊溶液变红色。
43.不稳定,易失水生成SiO2:H2SiO3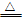 SiO2+H2O
SiO2+H2O
44.与碱溶液反应:H2SiO3+2NaOH===Na2SiO3+2H2O
45.硅酸浓度小时可形成硅酸溶胶(胶体),硅酸浓度较大时,则形成透明的、胶冻状的硅酸凝胶。
45.实验室采用水玻璃(硅酸钠水溶液)和盐酸反应或者硅酸钠溶液和CO2反应制得硅酸胶体。
相关反应为:Na2SiO3+2HCl=2NaCl+H2SiO3↓;Na2SiO3+CO2+H2O=Na2CO3+H2SiO3↓;
46.硅酸凝胶经干燥脱水得到多孔的硅酸干凝胶,称为“硅胶”。
47.硅胶多孔,吸附水分能力强,常用作干燥剂,也可以用作催化剂的载体(表面积大的特性)
47.变色硅胶中含有氯化钴(有很强的毒性),对空气中的水蒸气有极强的吸附作用,同时又能通过所含氯化钴结晶水数量变化而显示不同的颜色,即由吸湿前的蓝色随吸湿量的增加逐渐转变成浅红色。
若硅胶吸收较多的水份后(变为浅红色),吸附能力下降,此时应更换硅胶保持吸湿,这是硅胶优于CaO等干燥剂的原因,广泛用于精密仪器、皮革、鞋、服装、家用电器等。
硅胶吸附水分后,可通过热脱附方式将水分除去,从而重复利用。
48.硅酸盐是指由硅、氧和金属组成的化合物的总称,是构成地壳岩石的主要成分。
49.硅酸盐性质稳定,熔点较高,多数难溶于水(Na2SiO3易溶于水)
50.在硅酸盐中,Si和O构成了硅氧四面体,Si在中心,O在四面体的4个顶角;
许多这样的四面体还可以通过顶角的O相互连接。
51.硅酸盐矿物成分复杂,多用氧化物的形式表示它们的组成,如硅酸钠(Na2SiO3)表示Na2O·SiO2;
52.表示顺序是:活泼金属氧化物·较活泼金属氧化物·二氧化硅·水
镁橄榄石(Mg2SiO4)表示:2MgO·SiO2;钾云母(KH2Al3Si3O12)表示:K2O·3Al2O3·6SiO2·2H2O
高岭石[Al2Si2O5(OH)4]表示:Al2O3·2SiO2·2H2O正长石(KAlSi3O8)表示:K2O·Al2O3·6SiO2
55.Na2SiO3俗名:泡花碱,水溶液俗称水玻璃
56.Na2SiO3与酸反应:Na2SiO3+2HCl===H2SiO3(胶体)+2NaCl
57.Na2SiO3与少量CO2反应:Na2SiO3+CO2(少量)+H2O===Na2CO3+H2SiO3(胶体)
58.Na2SiO3与过量CO2反应:Na2SiO3+2H2O+2CO2(过量)===H2SiO3(胶体)+2NaHCO3
59.Na2SiO3可用于①制硅酸;②黏合剂(矿物胶);③耐火阻燃材料;④防腐剂
60.传统无机非金属材料特指玻璃、水泥、陶瓷等硅酸盐材料。
61.制备水泥主要原料:石灰石和粘土,
62.制备玻璃主要原料:纯碱、石灰石、石英(过量)
63.制备陶瓷主要原料:黏土,
64.水泥具有水硬性(跟水掺和搅拌后容易凝固变硬)。
65.玻璃是非晶体,无固定熔点,在一定范围内软化可制成各种形状。
66.陶瓷具有抗氧化、抗酸碱腐蚀、耐高温、绝缘(熔融NaOH不在坩埚中进行)
67.新型陶瓷在组成上不再限于传统的硅酸盐体系,在光学、热学、电学、磁学等方面具有很多新的特性和功能。
68.碳化硅(SiC):俗称金刚砂,碳、硅原子通过共价键连接,具有类似金刚石的结构,硬度很大,可用作砂纸和砂轮的磨料。碳化硅还耐高温,可用作耐高温结构材料、耐高温半导体材料等。
69.高温结构陶瓷一般用SiC、Si3N4或某些金属氧化物等在高温下烧结而成,具有耐高温、抗氧化、耐腐蚀等优良性能。与金属材料相比,更能适应严酷的环境,可用于发动机、高温电极材料等。
70.压电陶瓷主要有钛酸盐和锆酸盐等,能实现机械能与电能的相互转化。
可用于滤波器、扬声器、超声波探伤器和点火器等
71.透明陶瓷主要有氧化铝、氧化钇等氧化物透明陶瓷和氮化铝、氟化钙等非氧化物透明陶瓷,具有优异的光学性能,耐高温,绝缘性好。可用于高压钠灯、激光器和高温探测器等。
72.超导陶瓷在某一临界温度下电阻为零,具有超导性,可用于电力、交通、医疗等领域。
73.碳纳米材料是近年来人们十分关注的一类新型无机非金属材料,有着广阔的应用前景。
74.1985年,富勒烯的足球结构被发现,由碳原子构成的一系列笼形分子的总称,代表物C60。
76.石墨烯,只有一个碳原子直径厚度的单层石墨,实际上石墨烯本来就存在于自然界,只是难以剥离出单层结构。石墨烯一层层叠起来就是石墨,厚1毫米的石墨大约包含300万层石墨烯。铅笔在纸上轻轻划过,留下的痕迹就可能就是几层甚至仅仅一层石墨烯。
76.石墨烯具有优异的光学、电学、力学特性,在材料学、微纳加工、能源、生物医学和药物传递等方面具有重要的应用前景,被认为是一种未来革命性的材料,广泛应用于光电器件、超级电容器、电池和复合材料等。
75.碳纳米管,可以看做是石墨烯片层卷曲而成,具有纳米尺度的直径,因此按照石墨烯片的层数可分为:单壁碳纳米管(或称单层碳纳米管)和多壁碳纳米管(或多层碳纳米管),单壁管典型直径在0.6-2nm,多壁管最内径可达0.4nm,最粗可达数百纳米,但典型管径为2-100nm。
75.碳纳米管作为一维纳米材料,重量轻,六边形结构连接完美,具有许多异常的力学、电学和化学性能。
碳纳米管的硬度与金刚石相当,却拥有良好的柔韧性,可以拉伸。碳纳米管的结构虽然与高分子材料的结构相似,但其结构却比高分子材料稳定得多。碳纳米管是目前可制备出的具有最高比强度的材料。若将其他工程材料作为基体与碳纳米管制成复合材料, 可使复合材料表现出良好的强度、弹性、抗疲劳性及各向同性,给复合材料的性能带来极大的改善。此外,碳纳米管的熔点是已知材料中最高的。近些年随着碳纳米管及纳米材料研究的深入其广阔的应用前景也不断地展现出来,主要用于生产复合材料、电池和传感器等。

- 全部评论(0)
