深度认识一下双氧水
时间:2023-09-04 08:28 来源:未知 作者:王笃年 点击:次 所属专题: 过氧化氢
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.比水重
双氧水分子比水多一个氧原子,物理性质各方面都“重”,好比CO2与CO的比较。比如常温下密度接近1.5g/mL,沸点约150℃,均远高于水。它的酸性也比水强,常温下Ka=1.6×10-12。
常用的双氧水试剂是30%的溶液,医疗消毒用的是浓度为3%的稀溶液。消毒利用它的强氧化性。无论它做氧化剂还是还原剂,最大的好处是没有杂质遗留。
二.半开何为
H2O2分子的四个原子不在一条直线,也不在一个平面上,像是一本半开的书,两个平面的夹角和H-O-O键角均略大于直角。真的是“半”开。
O原子轨道sp3杂化,H-O-O自然不会直线,这个没问题。为什么没有(全开)共平面呢?无论是两个H原子间的距离还是O-O间孤电子对的距离都是共平面时最远,事实却是扭了近90°,这斥力是怎么算的呢?
三.一山二虎
多数分解反应吸热,双氧水的分解却是放热的:
2H2O2(l)→2H2O(l)+O2(g)ΔH°= -196kJ
原因可以说是H2O2的标准生产焓(-188kJ/mol)比H2O(-286kJ/mol)小,就是说H2O2的稳定性本来就明显比H2O差。一山难容二虎啊。加上有气态氧生成,该分解反应还是增熵的,自然很自发的。光照、重金属离子和碱性都能催化加速双氧水的分解。
四.进退自如
氧化性常常跟不稳定性挂钩,比如HNO3、KMnO4、HClO都容易分解出氧,同时也具有强氧化性。H2O2亦然。
来看H2O2的四种典型的半反应。
1.酸性条件下作为氧化剂(这是最招牌的一种半反应)
H2O2+2H++2E→2H2O E°=1.77V
该标准电极电势比硝酸(NO3-,H+/NO的E°=0.96V)还高,它是强氧化剂。例如
H2O2+2Fe2++2H+→2Fe3++2H2O
(该反应中Fe3+会同时催化H2O2的分解)
2.碱性条件下作为氧化剂:
H2O2+2E→2OH- E°=0.88V
它还是个中等强度的氧化剂(Fe3+/Fe2+的E°=0.77V),例如
3H2O2+2CrO2-+2OH-→2CrO42-+4H2O
3.酸性条件下作为还原剂(遭遇了比它更凶悍的强氧化剂,还原产物是O2)
H2O2-2e→O2↑+2H+ E°=0.70V
例如:5H2O2+2MnO4-+6H+→2Mn2++5O2↑+8H2O
4.碱性条件下放出氧气作为还原剂
H2O2-2e+2OH-→O2↑+2H2O E°= -0.08V
例如:H2O2+2MnO4-→2MnO2↓+2O2↑+2OH-
五.催化制取H2O2
一是通过BaO制取。
先将BaO在氧气中加热生成BaO2,再与酸反应,BaO2+H2SO4→BaSO4↓+H2O2。这相当于一个复分解反应。
如果改H2SO4为CO2+H2O(假定后者能替代),生成的BaCO3再分解,则总反应相当于2H2O+O2→2H2O2,BaO和CO2或BaCO3相当于催化剂,实现了水和氧的化合。是BaO(抑或是Na2O)提供了产生过氧离子的机会。
二是目前常用的蒽醌法。
蒽(C14H10)是三个苯环并联,共有10个H原子可供取代,取代基的位置编号依次是右边苯环顺时针数1234,然后左边苯环顺时针数5678,中间苯环的两个位置为9和10。乙基蒽醇就是2-乙基-9,10-二羟基蒽。先用O2将乙基蒽醇氧化为乙基蒽醌,即将两个羟基氧化为两个碳基,然后再用H2将乙基蒽醌还原
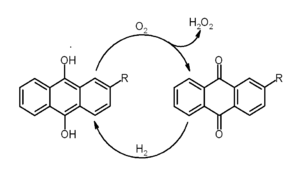
总反应相当于O2+H2→H2O2,除所用过渡金属外乙基蒽醇是催化剂,将氧和氢化合成了H2O2。是乙基蒽醇提供了产生O-O键的可能。
三是电解法。
先电解硫酸氢钾饱和溶液:
2HSO4-→H2(阴极)+S2O82-(阳极)
(挺神奇的电解,如果是电解硫酸或硫酸盐的稀溶液,阳极应该产生O2吧)
再将电解所得过硫酸钾酸化水解(其实是将水部分氧化):
S2O82-+2H2O→2HSO4-+H2O2
反应结果相当于2H2O→H2+H2O2,HSO4-相当于催化剂。这是唯一的水分解法,当然电解是主要手段。是过硫酸造就的双氧。

- 全部评论(0)
