常见有机物分离提纯的几种方法
时间:2024-04-22 15:32 来源:未知 作者:化学自习室 点击: 次 所属专题: 有机物分离提纯
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
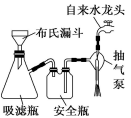
一、过滤

1、原理:根据固体的溶解度不同,将不溶性固体从溶液中分离出来的方法。
2、条件:一种固体不溶,一种固体可溶。
3、范围:适用于不溶固体和液体的分离。
4、仪器:漏斗、铁架台、烧杯、玻璃棒、滤纸
5、注意:一贴二低三靠;对于有些溶液温度下降,会有晶体析出,应该趁热过滤。
6、列举:草酸钙中混有醋酸钙:加水溶解,过滤除去醋酸钙溶液。
抽滤:又称减压过滤,真空过滤,指利用抽气泵使抽滤瓶中的压强降低,达到固液分离的目的方法。
二、洗气
1、原理:利用气体的溶解性或者化学性质不同,将混合气体分离开来的方法。
2、条件:一种气体不溶或不反应,一种气体可溶或可反应。
3、范围:适合于混合气体的分离。
4、仪器:洗气瓶、导管
5、注意:不要引进新的气体杂质,最后能够产生被提纯的气体。
6、列举:甲烷中混有乙烯:将混合气体通过溴的四氯化碳溶液,洗去乙烯。
三、蒸发
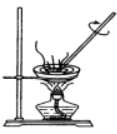
1、原理:把可溶性固体从溶剂中分离出来的方法。
2、条件:固体可溶
3、范围:适合于把可溶性固体从溶剂中分离出来。
4、仪器:铁架台、蒸发皿、酒精灯、玻璃棒
5、注意:玻璃棒作用;溶剂易挥发或易燃烧,采用水浴加热。
6、列举:从醋酸钠溶液中提取醋酸钠:蒸发溶液,使醋酸钠析出。
四、结晶
1、原理:通过蒸发溶剂或者降低温度使溶质的溶解度变小,从而使晶体析出的方法。
2、条件:固体的溶解度小或者固体的溶解度随温度升高变化较大。
3、范围:固体的溶解度小一般用蒸发结晶法;固体的溶解度随温度升高变化较大,一般用冷却结晶法或者重结晶法。
4、仪器:过滤、蒸发仪器。
5、注意:基本环节:溶解—蒸发浓缩—趁热过滤—冷却结晶—洗涤干燥
6、列举:苯甲酸钠中混有氯化钠:加水溶解,蒸发浓缩,冷却结晶,就可以除去氯化钠。
结晶的方法:①蒸发结晶;②降温结晶(蒸发浓缩、冷却结晶)
蒸发结晶:蒸发溶剂,使溶液由不饱和变为饱和,继续蒸发,过剩的溶质就会呈晶体析出
降温结晶:先加热溶液,蒸发溶剂成饱和溶液,此时降低热饱和溶液的温度,溶解度随温度变化较大的溶质就会呈晶体析出。
结晶方法的选择:
Ⅰ、当溶液为单一溶质时:
①晶体不带结晶水,如NaCl、KNO3等:蒸发结晶;
②晶体带结晶水,如胆矾等:将滤液蒸发浓缩、冷却结晶、过滤。
Ⅱ、当溶液为两种以上溶质时:
①得到溶解度受温度影响小的溶质:蒸发浓缩结晶,趁热过滤 (如除去NaCl中少量的KNO3);
②得到溶解度受温度影响大的溶质:蒸发浓缩、冷却结晶,过滤(如除去KNO3中少量的NaCl)。
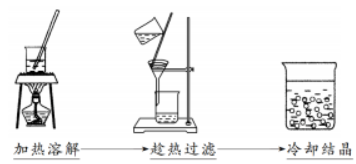
重结晶:是将晶体溶于溶剂以后,又重新从溶液结晶的过程。重结晶可以使不纯净的物质获得纯化,或使混合在一起的盐类彼此分离。
过程:
1.将需要纯化的化学试剂溶解于沸腾或将进沸腾的适宜溶剂中;
2.将热溶液趁热过滤,以除去不溶的杂质;
3.将滤液冷却,使结晶析出;
4.滤出结晶,必要时用适宜的溶剂洗涤结晶
(1)适用条件
①重结晶是提纯固态有机物的常用方法。②杂质在所选溶剂中溶解度很小或很大,易于除去。
③被提纯的有机物在所选溶剂中的溶解度,受温度的影响较大;该有机物在热溶液中的溶解度较大,在冷溶液中的溶解度较小,冷却后易于结晶析出。
(2)实验仪器与操作步骤
五、分液
1、原理:把互不相溶的液体分离开来的方法。
2、条件:液体互不相溶
3、范围:适合于互不相溶的液体分离。
4、仪器:分液漏斗、烧杯
5、注意:分液漏斗的基本操作
6、列举:己烷中混有己烯:加入酸性高锰酸钾溶液,振荡后用分液漏斗分离。
六、萃取
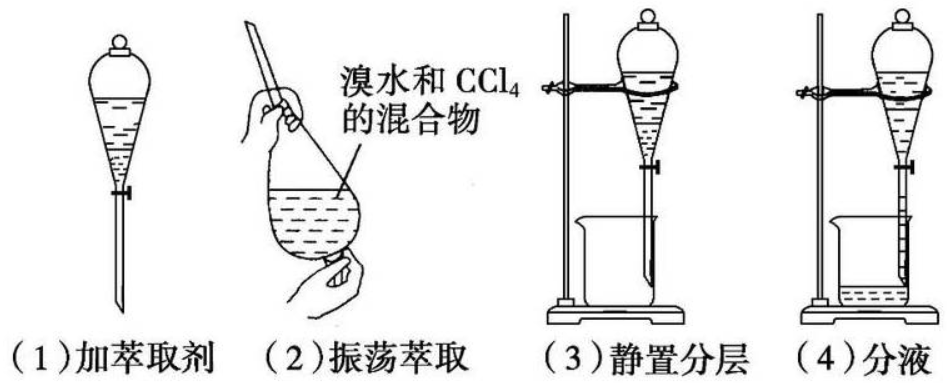
(1)萃取原理
①液—液萃取:利用有机物在两种互不相溶的溶剂中的溶解性不同,将有机物从一种溶剂转移到另一种溶剂的过程。
②固—液萃取:用有机溶剂从固体物质中溶解出有机物的过程。
(2)仪器:分液漏斗、烧杯、铁架台。
(3)操作要求:加萃取剂后充分振荡,静置分层后,打开分液漏斗活塞,从下口将下层液体放出,并及时关闭活塞,上层液体从上口倒出。
(4)萃取剂选用原则:1.萃取剂和原溶剂互不混溶。2.萃取剂和溶质互不发生反应。3.溶质在萃取剂中的溶解度远大于在原溶剂中的溶解度
(5)反萃取:是用反萃取剂使被萃取物从负载有机相返回水相的过程,为萃取的逆过程。反萃取可将有机相中各个被萃组分逐个反萃到水相,使被分离组分得到分离;也可一次将有机相中被萃组分反萃到水相。经过反萃取及所得反萃液经过进一步处理后,便得到被分离物的成品。反萃后经洗涤不含或少含萃合物的有机相称再生有机相,继续循环使用。
七、蒸馏
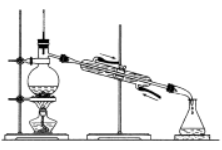
1、原理:利用液体的沸点不同,经过加热冷凝使液体分离的操作。
2、条件:液体的沸点相差比较大。
3、范围:适合于沸点不同的液体的分离。
4、仪器:酒精灯、铁架台、石棉网、蒸馏烧瓶、冷凝管、接应管、锥形瓶、温度计
5、注意:温度计位置;逆流冷凝。
6、列举:酒精中混有水,加氧化钙,蒸馏可除去水。
八、渗析
1、原理:利用半透膜能够透过离子或分子,不能透过胶粒的性质分离提纯胶体的操作。
2、条件:一种是胶体,一种是溶液
3、范围:适合分离胶体和溶液。
4、仪器:烧杯、半透膜袋
5、注意:最好在流动的水中进行
6、列举:鸡蛋白中混有少量氯化钠:把混合溶液装在半透膜袋中,置于流动的水中。
九、盐析
1、原理:利用轻金属盐能够降低胶体的溶解度的性质,分离提纯胶体的方法。
2、条件:一种是胶体,一种是溶剂
3、范围:适合胶体和溶剂的分离
4、仪器:烧杯、过滤装置
5、注意:方法是盐析,操作是过滤
6、列举:硬脂酸钠中混有甘油:加少量食盐,使硬脂酸钠析出,然后过滤分离。
十、色谱
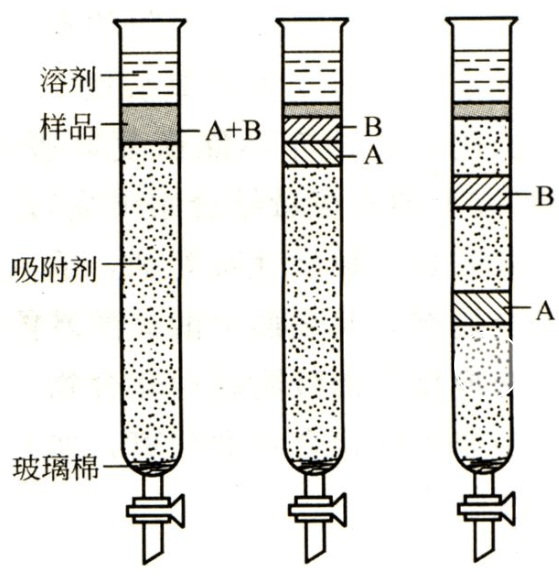
1、原理:利用吸附剂对不同有机物的吸附作用不同分离提纯有机物的操作。
2、条件:同一吸附剂吸附有机物能力不同。
3、范围:适合分离吸附能力不同的有机物。
4、仪器:吸附柱
5、注意:选择碳酸钙、硅胶、氧化铝、活性炭等吸附剂
6、列举:叶绿素和叶黄素的分离:以碳酸钙粉末为吸附剂,装入吸附柱中,加入混合物分离。
【鉴别】
常见有机物的鉴别主要根据有机物分子结构中所含官能团不同,
常用试剂 | 产生的现象 | 官能团确定 | 常见有机物类别 |
金属钠 | 产生气体(H2) | 含—OH | 醇、酚、羧酸 |
NaHCO3 | 产生气体(CO2) | 羧酸 | |
KMnO4(H+)溶液 | 褪色 | 不饱和键、有侧链的苯环、羟基、醛基 | 烯、炔、苯的同系物、醇、酚、醛、醛糖 |
溴水 | 褪色、产生白色沉淀 | 不饱和键、醛基、酚羟基 | 烯、炔、醛、醛糖、酚 |
萃取分层 | —X | 烷烃、芳烃、卤代烃 | |
银氨溶液 | 热水浴,产生银镜 | 醛、甲酸、甲酸酯、葡萄糖 | |
新制Cu(OH)2 | 常温,蓝色沉淀溶解 加热产生红色沉淀 | 低级羧酸、 醛、甲酸、 甲酸酯、葡萄糖 | |
FeCl3溶液 | 溶液变紫色 | 酚羟基 | 酚 |
说明:A.醇、酚、羧酸的鉴别能用其它方法时不能用金属钠。B.不同有机物的鉴别有时也可利其水溶性和密度(如烃、酯比水轻,而溴代烃、四氯化碳、硝基苯比水重)。
【分离和除杂质】
有机物的分离或除杂质一般根据各有机物的化学性质、常温状态、溶解性、沸点的不同,常采用洗气、分液或蒸馏的方法。
a.固—固混合分离型:灼烧、升华、热分解、结晶(重结晶)等。
b.固—液混合分离型:过滤、盐析、蒸发结晶、冷却结晶(重结晶)等。
c.液—液混合分离型:萃取、分液、蒸馏等。
d.气—气混合分离型:洗气(采用液体净化剂时用洗气瓶,采用固体净化剂时用干燥管)。
在一个具体的分离和提纯过程中,往往同时用到几种不同的方法,同时还要使用化学方法。其基本原则是:
(1)尽可能使加入的试剂只跟杂质发生作用;
(2)提纯物质过程不能引入新的杂质;
(3)杂质与试剂反应生成的产物易分离出来;
(4)提纯过程应做到方法简单、现象明显、分离容易、所得产物纯度高;
(5)尽可能将杂质转化为原料;
(6)若要求“分离”则必须恢复被提纯物质原来的组成和状态:即“不增、不减、易分、复原”四原则。
(1)分离:常见不同状态的有机混合物的分离方法如下表:
| 有机混合物 | 分离方法 | 使用主要仪器 |
气体混合物 | 洗气 | 洗气瓶 |
不相溶的液体混合物 | 分液 | 分液漏斗 |
相溶液体(沸点差距大) | 蒸馏 | 蒸馏烧瓶 |
(2)除杂质
常见有机化合物中含有的杂质、除杂试剂和方法如下表:(括号内物质为杂质)
| 有机混合物 | 常用除杂试剂 | 方法 |
①CH4(C2H4) | 溴水 | 洗气 |
②CH3CH2Br(乙醇) | 水 | 分液 |
③CH3CH2OH(H2O) | 新制生石灰 | 蒸馏 |
④乙酸乙酯(乙酸) | 饱和Na2CO3溶液 | 分液 |
⑤苯(甲苯) | 高锰酸钾溶液、氢氧化钠溶液 | 蒸馏 |
⑥.溴苯(溴) | 氢氧化钠溶液 | 分液 |
⑦苯(苯酚) | 氢氧化钠溶液 | 分液 |
⑧.硝基苯(硝酸、硫酸) | 氢氧化钠溶液 | 分液 |

- 全部评论(0)
