硅的化合物释疑
时间:2023-11-29 16:24 来源:摘抄于因特网 作者:王瑜 点击: 次 所属专题: 硅及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1.实验室盛放碱液的试剂瓶要用橡胶塞而不能用玻璃塞,原因是玻璃成份中的SiO2要和NaOH反应生成Na2SiO3,将玻璃瓶口和玻璃塞粘住。可为什么试剂瓶壁却不与NaOH溶液反应呢?
事实证明:NaOH和玻璃中SiO2的反应速率、程度与NaOH的浓度、反应的温度及仪器表面的光滑度有关。盛放NaOH溶液的试剂瓶口内壁、玻塞只所以能和碱液发生反应是因为瓶口内壁和瓶塞经磨砂处理后,表面变得粗糙,形成无数的突起和棱角,这既增加了反应的活性,又造成了溶液的滞留,而且由于水份的逐渐蒸发会使NaOH溶液浓度增大,常温下碱溶液长时间与玻塞附近的玻璃接触就发生了反应生成Na2SiO3,使瓶口与瓶塞粘在一起。而光滑度很好的玻璃与碱液接触,即使加热也极难反应。较长时间加热盛NaOH溶液的试管不见任何现象,就可以证明这一点。但如果把NaOH固体和SiO2混合加热,则反应很容易进行。我们可以用一个实验来证实:在一个小试管中放入少量固体NaOH,夹持在铁架台上加热,NaOH熔融(熔点318.4℃)后,再加热较短时间,冷却,可观察到试管底失去透明现象,这是由于玻璃受到了融熔NaOH的腐蚀。如果加热较长时间,熔融的NaOH则会穿透试管底。
2.为什么配制![]() 溶液时要加入少量锡,而在
溶液时要加入少量锡,而在![]() 悬浊液中通入
悬浊液中通入![]() 气体会生成白色沉淀?
气体会生成白色沉淀?
碳族元素中,碳、硅、锗、锡的+4价化合物稳定,而铅的+2价化合物稳定。在![]() 溶液中
溶液中![]() 容易被氧化为
容易被氧化为![]() ,即
,即![]() 具有还原性;所以在配制
具有还原性;所以在配制![]() 溶液时加入锡,可防止它被氧化(
溶液时加入锡,可防止它被氧化(![]() )。而
)。而![]() 具有氧化性,能将
具有氧化性,能将![]() 氧化生成
氧化生成![]() ,所以在
,所以在![]() 悬浊液中通入
悬浊液中通入![]() 气体会生成白色沉淀。
气体会生成白色沉淀。
3.二氧化碳与硅酸钠溶液反应可以生成硅酸,另外生成的是Na2CO3还是NaHCO3?
H2CO3是二元弱酸,其电离常数K1=4.30×10-7K2=5.61×10-11,H2SiO3是更弱的二元酸,其电离常数K3=2.0×10-10,K4=1.0×10-12,两者相比得K1>K3>K2>K4,所以酸性强弱的次序为:H2CO3>H2SiO3>HCO3- ,因此CO2与Na2SiO3溶液反应时,一般情况下是生成NaHCO3,但当CO2的量不足或很少时,也会生成Na2CO3。
4.硅酸和常见含氧酸相比有什么特点?
硅酸和常见含氧酸相比,特点主要有:
(1)组成复杂。硅酸为组成复杂的白色固体,常随形成条件的不同而有不同的组成。主要有:硅酸(H2SiO3)、原硅酸(H4SiO4)、二硅酸(H6Si2O7)、三硅酸(H4Si3O8)等。在各种硅酸中常以硅酸的组成最简单,所以常用H2SiO3这一化学式代表硅酸。
(2)制法不同。SiO2为硅酸的酸酐,由于SiO2不溶于水,所以不能用SiO2与水直接反应得到硅酸,而只能用可溶性硅酸盐与酸反应制取。
(3)难溶弱酸。在常见含氧酸中,只有硅酸难溶于水,且酸性极弱,它不能使指示剂变色。
(4)极易缩合。一般来说,含氧酸的酸性越弱,缩合性越强(H2CO3除外)。在常见的含氧酸中,原硅酸(H4SiO4)缩合性最强,它经过脱水可得到一系列酸,包括硅酸和多硅酸。
(5)易成凝胶。在可溶性硅酸盐中加入酸,开始生成单分子硅酸,当单分子硅酸逐渐缩合为多硅酸时,就形成硅酸溶胶。在此溶液中加入电解质,或者在适当浓度的硅酸的溶液中加入酸则得到半凝固状态、软而透明、且有弹性的硅酸凝胶。
5.为什么常用氧化物的形式来表示硅酸盐的组成?
硅酸盐不同于普通的其它盐类,结构一般比较复杂。在硅酸盐中,硅原子处于一个正四面体中心,以共价键和处于四面体四个顶点的氧原子相结合形成硅氧四面体。除了可以由单个的硅氧四面体和金属阳离子形成硅酸盐外,还可由许多个硅氧四面体彼此连接成链状、环状、片状或三维空间网状结构,金属阳离子则分布在链、环、片或网的空隙之间。所以,硅酸盐既可以看作是金属的硅氧化合物,也可以看作是酸性氧化物和碱性氧化物组成的复杂化合物。因此,硅酸盐的化学式一般并不表示硅酸盐中就含有简单的离子或分子,即硅酸盐的化学式一般并不表示硅酸盐的结构,它们仅仅能表示硅酸盐中各元素原子的相对比例而已。为了更直观更清楚的表示硅酸盐的组成,多数情况下,可以用二氧化硅和金属氧化物的形式表示。其排列顺序为“碱性氧化物·两性氧化物·二氧化硅·水”(若碱性氧化物多于一种时,按钾、钠、钙、镁氧化物的顺序排列)。如高岭石![]() 可表示为:
可表示为:![]() 。
。
6. 碳和硅为什么容易生成共价化合物?
碳和硅都是元素周期表第IVa族的非金属元素,第IVa族元素位于周期表里容易失去电子的主族元素和容易得到电子的主族元素的中间位置,其原子核外最外层都有4个电子,既不容易得到4个电子形成离子,又不容易失去4个电子形成离子,所以它们容易生成共价化合物。
7.如何表示硅与NaOH溶液反应的电子转换情况?
硅与NaOH溶液反应的实质分两步进行。
第一步Si与![]() 反应(为氧化还原反应,其中Si是还原剂,
反应(为氧化还原反应,其中Si是还原剂,![]() 是氧化剂)生成
是氧化剂)生成![]() (
(![]() 不稳定又失去水生成
不稳定又失去水生成![]() )和
)和![]() :
:![]() ;
;
第二步![]() 与
与![]() 反应(为非氧化还原反应)生成
反应(为非氧化还原反应)生成![]() 和
和![]() 。
。
其总化学方程式为![]() (通常写为
(通常写为![]() ),
),
其电子转移情况用“单线桥”法可表示为:
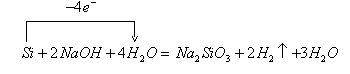
8. ![]() 能与水反应生成
能与水反应生成![]() 也能与水反应生成
也能与水反应生成![]() 吗?
吗?
![]() 是
是![]() 的酸酐,通常1体积水可溶解1体积
的酸酐,通常1体积水可溶解1体积![]() ,溶解的
,溶解的![]() 部分与水反应生成
部分与水反应生成![]()
![]()
![]()
![]() 虽为
虽为![]() (也为
(也为![]() )的酸酐,但
)的酸酐,但![]() 不溶于水,也不与水反应,所以
不溶于水,也不与水反应,所以![]() 不能与水反应生成
不能与水反应生成![]() 。用
。用![]() 制
制![]() ,可将其溶于NaOH溶液,再滴加稀盐酸或通入
,可将其溶于NaOH溶液,再滴加稀盐酸或通入![]() 。
。
![]()
或![]()
9. 由反应![]() 可知
可知![]() 的酸性比
的酸性比![]() 强,而有的同学根据
强,而有的同学根据![]() 认为
认为![]() 的酸性比
的酸性比![]() 强,对吗?
强,对吗?
不对。根据元素周期律可知,碳的非金属性比硅强,从而可知![]() 的酸性比
的酸性比![]() 强。而酸性强弱通常又可根据溶液中的反应来比较,一般规律是较强的酸与较弱酸的盐反应生成较弱的酸。则由反应
强。而酸性强弱通常又可根据溶液中的反应来比较,一般规律是较强的酸与较弱酸的盐反应生成较弱的酸。则由反应![]()
![]()
![]() 可知
可知![]() 的酸性比
的酸性比![]() 强。而反应
强。而反应![]()
![]() 不是在溶液中而是在高温下进行的,所以不能据此比较其酸性强弱。
不是在溶液中而是在高温下进行的,所以不能据此比较其酸性强弱。
10. 如何制取高纯硅?
现在人们已经制得纯度达99.9999999999%(12个九)的晶体硅,这样高纯度的硅的制取过程为:
(1)首先用焦碳还原石英砂:
![]() (粗硅)
(粗硅)![]() ;
;
(2)粗硅与![]() 反应:
反应:
![]() (粗硅)
(粗硅)![]() ;
;
(3)用![]() 还原
还原
![]() ;
;
(4)生成的纯硅置于管式炉中,管式炉外加一电热圈,通电加热,使一端熔化,然后极其缓慢的从左端移到右端,多次重复移动,这样含有的杂质便被“扫”到另一端,把这端切下,其它部分便为纯度达12个九的晶体硅。
11. 为什么![]() 溶液等碱性溶液可盛装在玻璃试剂瓶中,但不能用玻璃塞?
溶液等碱性溶液可盛装在玻璃试剂瓶中,但不能用玻璃塞?
二氧化硅是普通玻璃的成分之一,其为酸性氧化物,它可与NaOH溶液等碱性溶液反应,但反应也受到温度、浓度、接触面积等外界条件的影响。如盛装NaOH溶液的试剂瓶,在瓶口处沾附的![]() 溶液易蒸发掉水分,使
溶液易蒸发掉水分,使![]() 溶液的浓度更大,同时因瓶塞是磨口的,表面凹凸不平,增大了与
溶液的浓度更大,同时因瓶塞是磨口的,表面凹凸不平,增大了与![]() 溶液的接触面积,使反应更易进行,生成的硅酸钠是一种矿物胶,时间一长使瓶塞与瓶子粘合在一起。对于瓶内因瓶壁光滑,
溶液的接触面积,使反应更易进行,生成的硅酸钠是一种矿物胶,时间一长使瓶塞与瓶子粘合在一起。对于瓶内因瓶壁光滑,![]() 与瓶体接触面积小,且瓶内
与瓶体接触面积小,且瓶内![]() 浓度较小,反应量非常微小,因此即使用玻璃试管或烧杯加热浓的
浓度较小,反应量非常微小,因此即使用玻璃试管或烧杯加热浓的![]() 溶液至沸腾,洗涤后仍可看到光亮的试管或烧杯。所以,
溶液至沸腾,洗涤后仍可看到光亮的试管或烧杯。所以,![]() 溶液等碱性溶液可盛装在玻璃试剂瓶中,但不能用玻璃塞,而应用橡皮塞或软木塞。
溶液等碱性溶液可盛装在玻璃试剂瓶中,但不能用玻璃塞,而应用橡皮塞或软木塞。
12. 碳和硅同主族,为什么![]() 和
和![]() 在物理性质上有很大差别?
在物理性质上有很大差别?
二氧化碳晶体是由![]() 分子构成的,固态
分子构成的,固态![]() (干冰)属分子晶体,分子间只有较小的分子间作用力(范德华力),很容易被破坏。而二氧化硅晶体是由硅原子和氧原子构成的原子晶体,原子间以较强的共价键相互作用,
(干冰)属分子晶体,分子间只有较小的分子间作用力(范德华力),很容易被破坏。而二氧化硅晶体是由硅原子和氧原子构成的原子晶体,原子间以较强的共价键相互作用,![]() 键的键能很大,很难被破坏。所以
键的键能很大,很难被破坏。所以![]() 和
和![]() 在物理性质上有很大差别。如:二氧化硅的熔点高(
在物理性质上有很大差别。如:二氧化硅的熔点高(![]() )、沸点高(
)、沸点高(![]() )、硬度大(莫氏硬底为7),而二氧化碳在通常状况下为气体,固体二氧化碳的熔点低(在
)、硬度大(莫氏硬底为7),而二氧化碳在通常状况下为气体,固体二氧化碳的熔点低(在![]() 下为
下为![]() )、沸点低(在
)、沸点低(在![]() 下,
下,![]() 升华)、硬度较小。
升华)、硬度较小。
13. 硅酸与原硅酸有何异同?
硅酸的化学式为![]() ,原硅酸的化学式为
,原硅酸的化学式为![]() 。硅酸和原硅酸均难溶于水,均为二元弱酸,其酸性比碳酸还弱,其酸酐均为
。硅酸和原硅酸均难溶于水,均为二元弱酸,其酸性比碳酸还弱,其酸酐均为![]() 。硅酸比原硅酸稳定。可溶性硅酸盐(如
。硅酸比原硅酸稳定。可溶性硅酸盐(如![]() )溶液跟酸(如盐酸)反应可生成原硅酸沉淀,原硅酸在空气里干燥失去一部分水可得到硅酸。
)溶液跟酸(如盐酸)反应可生成原硅酸沉淀,原硅酸在空气里干燥失去一部分水可得到硅酸。
![]()

- 全部评论(0)
