化学平衡常数的应用
时间:2016-02-02 21:23 来源:未知 作者:何永成 点击:次 所属专题: 化学平衡常数
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学平衡是反应原理中非常重要的知识之一,而平衡常数则是解决这一类平衡问题的重要手段和方法,如果平衡常数运用得当,往往可以起到事半功倍的效果。现从以下几个方面来介绍平衡常数在解题中的妙用。
一、判断反应进行的程度
K值越大,正反应进行的程度越大,反应物的转换率越高;K值越下,正反应进行的程度越下,逆反应进行的程度越大,反应物的转换率越低。
例1:(原创题)下列数据是一些反应的平衡常数,请判断:表示反应进行得最接近完全的常数是( )
A.K=3×103 B.K=2×10-10 C.K=3×105 D.K=2×1010
解析:K值越大,正反应进行的越完全。一般认为K>105时,即反应基本完成。故选D。
二、判断反应的热效应
K值的大小与浓度、压强和是否使用催化剂无关,只与温度这一外界条件有关,温度发生变化时平衡常数也会发生改变。温度越高,K值越大,则正反应为吸热反应;温度越高,K值越小,则正反应为放热反应。
例2:(08年山东理综;有改动)高温下,某反应达到平衡,平衡常数![]() 。恒容时,温度升高,K值变大。下列说法正确的是( )
。恒容时,温度升高,K值变大。下列说法正确的是( )
A.该反应的焓变为正值
B.恒温恒容下,增大压强,H2浓度一定减小
C.升高温度,逆反应速率减小
D.该反应的化学方程式为CO+H2O![]() CO2+H2
CO2+H2
解析:温度升高,K值变大,说明平衡向正反应移动,则正反应为吸热反应,故该反应的焓变为正值,A正确;恒温恒容下,增大压强,H2浓度应该增大或不变,故B错;升高温度,正逆反应速率都会增大,故C错;由平衡常数的表达式可得,该反应化学方程式应为CO2+H2 CO+H2O,故D错。答案选A。
CO+H2O,故D错。答案选A。
例3:![]() 1
1![]() .(09年江苏化学;有改动)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)
.(09年江苏化学;有改动)I2在KI溶液中存在下列平衡:I2(aq)+I-(aq)![]() I3-(aq)
I3-(aq)![]() ;某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
;某I2、、KI混合溶液中,I3-的物质的量浓度c(I3-)与温度T的关系如图所示(曲线上任何一点都表示平衡状态)。下列说法正确的是( )
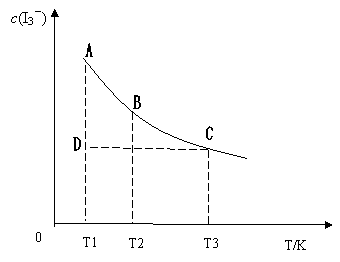
A. ![]() 反应 I2(aq)+I-(aq)
反应 I2(aq)+I-(aq)![]() I3-(aq)的△H>0
I3-(aq)的△H>0
![]() B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2
B.若温度为T1、T2,反应的平衡常数分别为K1、K2则K1>K2
![]() C.若反应进行到状态D时,平衡正移。
C.若反应进行到状态D时,平衡正移。
![]() D.状态A与状态B相比,状态A的c(I2)大
D.状态A与状态B相比,状态A的c(I2)大
解析:随着温度的不断升高,c(I3-)逐渐的减小,说明反应向逆方向移动,所以逆反应是吸热反应,正反应是放热反应,所以△H<0,故A项错;由A知△H<0,所以温度越高,K值越小,因T2>T1,故K1>K2, B项错;C项,从图中可以看出D点并没有达到平衡状态,所以它要向A点移动,这时c(I3-)在增加,所以平衡正移,C项正确;D项,从状态B到状态A,c(I3-)在增加,平衡正向移动,那么c(I2)就在减小,所以状态A的c(I2)小,D项错误;答案选C。
三、判断反应进行的方向
勒夏特列原理定义中减弱一词的含义较难理解,教学中使用平衡常数通过计算,定量进行比较,可以较好的突破平衡移动方向的判断难点。所以,平衡常数是将化学平衡移动原理定性的判定转化为定量的计算,从而使判断平衡移动更为准确。甚至用勒夏特列原理无法解释的问题,用平衡常数也可以快速的解决。

- 全部评论(0)
