元素周期律知识的概念组合、表达及联系
时间:2016-01-24 20:10 来源:http://blog.sina.com.cn/u/2114 作者:宋洲 点击:次 所属专题: 元素周期律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
同学们在学习元素周期表和元素周期律的内容时,常遇到有关概念混淆不清,表达不正确、不准确的困难。现将描述元素周期律的重要概念以表格的形式理顺:
表一
对 象 | 表 征 | 衡 量 |
元素的性质 | 非金属性、金属性 | 强弱 |
元素单质的性质 | 氧化性、还原性 | 强弱 |
元素原子 | 得失电子的能力 | 强弱 |
表格中的对应关系,不可错位,否则就是"混搭",属于化学用语上的表达错误。
所以对于金属元素来说,应这样表达:
1、元素的金属性强弱;
2、金属单质的还原性强弱;
3、金属原子失电子能力强弱。
对于非金属元素来说,应表达为:
1、元素的非金属性强弱;
2、非金属单质的氧化性强弱;
3、非金属原子得电子能力强弱。
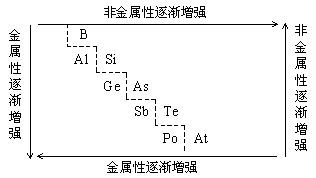
因此,在描述元素周期表中体现出来的元素周期率时,结合下表
| IA、 IIA、 IIIA、 IVA、 VA、 VIA、 VIIA |
1 2 3 4 5 6 7 |
|
总结如下:
内 容 | 同周期元素(左→右) | 同主族元素(上→下) |
元素的金属性与非金属性 | 金属性减弱,非金属性增强 | 金属性增强,非金属性减弱 |
单质的还原性与氧化性 | 还原性减弱,氧化性增强 | 还原性增强,氧化性减弱 |
原子得失电子能力 | 失电子能力减弱,得电子能力增强 | 失电子能力增强,得电子能力减弱 |
进一步研究会发现:
一、对于金属元素来说,三个层次:
1、元素的金属性强弱;
2、金属单质的还原性强弱;
3、金属原子失电子能力强弱。
它们之间的联系是:一强俱强;一弱俱弱。
二、对于非金属元素来说,三个层次:
1、元素的非金属性强弱;
2、非金属单质的氧化性强弱;
3、非金属原子得电子能力强弱。
它们之间的联系同样是:一强俱强;一弱俱弱。
各层次的递变规律性表现为"平行变化"。如此一来,理顺关系以后,元素周期律就非常容易掌握。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!