晨读笔记:元素周期律
时间:2023-08-09 16:44 来源:未知 作者:化学自习室 点击:次 所属专题: 元素周期律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
01.原子最外层电子排布变化规律:
同周期由左向右元素的原子最外层电子数逐渐增加(1→8)(第一周期1→2)
02.元素的主要化合价:
①同周期由左向右元素的最高正价逐渐升高(+1→+7,O和F无最高正价);
②元素的最低负价由Ⅳa族的-4价逐渐升高至Ⅶa族的-1价;
03.同一周期,以左→右,金属性递减;非金属性递增;
同一主族,从上→下,金属性递增,非金属性递减
04.钠、镁、铝与水反应的实验表明:
05.钠与冷水剧烈反应,镁与冷水几乎不反应,能与热水反应,铝与冷水不反应,与热水缓慢反应。
①钠、镁、铝置换出水(或酸)中的氢时,由易到难的顺序为:Na>Mg>Al
②钠、镁、铝的最高价氧化物对应的水化物的碱性由强到弱的顺序为NaOH>Mg(OH)2>Al(OH)3
③钠、镁、铝的金属性由强到弱的顺序为Na>Mg>Al
④同周期,随着核电荷数增大,与水反应越来越困难,氢氧化物的碱性越来越弱
06.硅、磷、硫、氯与氢气反应的实验表明:
①Si与氢气高温;磷蒸气与H2能反应;S与氢气加热反应,氯气与氢气光照时爆炸。
②硅、磷、硫、氯单质与氢气化合时条件由易到难的顺序为:Cl>S>P>Si
③硅、磷、硫、氯最高价氧化物对应水化物的酸性顺序为:HClO4>H2SO4>H3PO4>H2SiO3
④硅、磷、硫、氯元素非金属性由强到弱的顺序为:Cl>S>P>Si
07.元素周期律是指元素的性质随着原子序数的递增而呈现周期性的变化
08.呈现周期性的变化内容有:原子半径、主要化合价、金属性、非金属性等
09.同周期元素从左到右:元素金属性逐渐减弱、元素非金属性逐渐增强、元素失电子逐渐减弱、元素得电子逐渐增强、单质还原性逐渐减弱、单质氧化性逐渐增强、阳离子氧化性逐渐增强、阴离子还原性逐渐减弱、气态氢化物的形成越来越容易,其稳定性逐渐增强、最高价氧化物对应水化物碱性逐渐减弱,酸性逐渐增强
10.元素金属性逐渐增强、元素非金属性逐渐减弱、元素失电子逐渐增强、元素得电子逐渐减弱、
单质还原性逐渐增强、单质氧化性逐渐减弱、阳离子氧化性逐渐减弱、阴离子还原性逐渐增强、气态氢化物的形成越来越困难,其稳定性逐渐减弱、最高价氧化物对应水化物的碱性逐渐增强、酸性逐渐减弱
11.微粒半径大小的判断规律:
①同一元素不同价态的微粒,价态越高,半径越小,如r(H-)>r(H)>r(H+),或r(Fe2+)>r(Fe3+)等。
②同周期原子半径随原子序数递增逐渐减小;如:r(Na)>r(Mg)>r(Al)
③同周期阳离子半径随原子序数递增逐渐减小,如:r(Na+)>r(Mg2+)>r(Al3+)
④同周期阴离子半径随原子序数递增逐渐减小,如:r(N3- )>r(O2-)>r(F-)
⑤同主族阳离子半径随原子序数递增逐渐增大,如:r(Li+)<r(Na+)<r(K+)<r(Rb+)<r(Cs+)
⑥同主族阴离子半径随原子序数递增逐渐增大,如:r(F-)<r(Cl-)<r(Br-)<r(I-)
⑦同周期阴离子半径大于阳离子半径,如:r(Cl-)>r(F-)>r(Na+),即r(Cl-)> >r(Na+)
12.金属性强弱判断的依据
①根据金属活动顺序表,从左→右,金属性递减;Fe排在Cu的前面,则金属性:fe>cu。
②根据元素周期律,同周期靠左,金属性强;同主族靠下,金属性强,故金属性Cs最强。
③根据金属间的置换反应,活泼金属可以将不活泼金属从其盐溶液中置换出来;
Zn+Cu2+===Zn2++Cu,则金属性:Zn>Cu
④根据金属与水或与酸反应置换出H2的难易程度,越容易置换出氢,金属性越强;
Zn与盐酸反应比Fe与盐酸反应更容易,则金属性:Zn>Fe
⑤根据最高价氧化物对应的水化物的碱性,碱性越强,金属性越强;
碱性:NaOH > Mg(OH)2> Al(OH)3,则金属性:Na>Mg>Al
⑥金属阳离子的氧化性越强,金属的金属性越弱;氧化性:Mg2+>Na+,则金属性:Mg<Na
13.非金属性强弱判断的依据:
①根据元素周期律,同周期,靠右非金属性强;同主族,靠上非金属性强,故非金属性F最强;
②根据非金属间的置换反应;如:Cl2+2KI===2KCl+I2,则非金属性:Cl>I
③根据与H2化合的难易程度,越容易与H2化合,非金属性越强;
如:F2与H2在黑暗中就可反应,Br2与H2在加热条件下才能反应,则非金属性:F>Br
④根据气态氢化物的稳定性,气态氢化物越稳定,非金属性越强;
如:如稳定性:HF>HCl,则非金属性:F>Cl
⑤根据最高价化合物对应水化物的酸性,酸性越强,非金属性越强;
如:HClO4(最强酸)>H2SO4(强酸)>H3PO4(中强酸)>H2SiO3(弱酸),则非金属性:Cl>S>P>Si
⑥依据与同一种金属反应,生成化合物中金属元素的化合价的高低进来比较:化合价越高,则非金属性越强。如:Cu+Cl2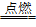 CuCl2,2Cu+S
CuCl2,2Cu+S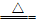 Cu2S,即得非金属性:Cl>S。
Cu2S,即得非金属性:Cl>S。

- 全部评论(0)
