构建微粒观,解决化学问题
时间:2015-12-12 19:56 来源:未知 作者:甑炳杨 点击:次 所属专题: 化学观念 解题思维 微粒观
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学是研究物质的一门科学,物质是由微粒构成的,物质无限可分,大宇宙,小微粒,走进微观世界去研究物质,用微粒观去解决具体物质的化学问题,有其重要的意义和奇妙的作用。本文借助于2011年全国各地高考试题的解析,谈谈构建并应用微粒观的体会。
一、物质结构中的微粒观
物质都是由不同微观粒子构成的。构成物质的“三子”为分子、原子、离子,构成原子的“三子”为质子、中子、电子。物质的结构决定物质的性质,微粒间存在相互作用,从而使微观粒子聚集成宏观物质。物质结构涵盖了原子结构、分子结构、晶体结构等,与每一种具体物质都有着密不可分的联系,因此,研究或理解具体物质的化学问题时,要全面深入微观世界去分析、解释、论证。
有关原子结构内容的重要考点:①原子的各种量(质量数、质子数、电子数和中子数)关系的考查;②8电子、10电子、18电子等结构的应用考查;③结合周期表知识和“位、构、性”间的关系进行微粒(原子或离子)核外电子排布规律的考查;④考查微粒半径大小比较规律等。
有关分子结构内容的重要考点:①各种微粒形成各种化学键和分子间作用力的考查;②各种化学键概念的微观分析的考查;③考查杂化轨道等理论分析分子空间构型。
有关晶体结构内容的重要考点:①构成各类晶体的内部微粒、微粒间的作用力以及微粒分布情况的考查;②考查利用晶胞等图形和分摊法计算晶体中微粒个数比;③考查晶体熔沸点高低比较规律等。
例1.(2011浙江高考9)X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物在标准状况下的密度为0.76 g·L-1;W的质子数是X、Y、Z、M四种元素质子数之和的1/2。下列说法正确的是(
A.原子半径:W>Z>Y>X>M
B.XZ2、X2M2、W2Z2均为直线型的共价化合物
C.由X元素形成的单质不一定是原子晶体
D.由X、Y、Z、M四种元素形成的化合物一定既有离子键,又有共价键
解析:本题要依据题设五种原子的最外层电子数、质子数等微粒间的数量关系进行推断五种元素。X、Y、Z三种元素的原子最外层电子数之和为15,且三种同周期元素的原子序数依次递增,知X、Y、Z依次为C、N、O;依题意Y与M形成的气态化合物相对分子质量为17,知M元素为H;W的质子数是X、Y、Z、M四种元素质子数之和的1/2,则W元素为Na。选项A是比较微粒半径大小,由X、Y、Z三元素知原子半径大小为:C>N>O,显然Z>Y>X错误。选项B中的XZ2、X2M2、W2Z2分别为CO2、C2H2、H2O2,CO2和C2H2为直线型分子,而H2O2为折线型分子,选项B错误。由X元素形成的单质可以是混合型晶体石墨,也可以是分子晶体C60等,选项C正确。由X、Y、Z、M四种元素形成的化合物可以是NH4HCO3、CH3COONH4等为离子化合物,符合条件;也可以是CH3NO2(硝基甲烷)、H2NCH2COOH(氨基乙酸)等有机物均为共价化合物,不存在离子键,选项D错误。
答案:C。
感悟:本题是借助元素周期律和元素周期表知识考查推理判断能力,试题中还渗透了原子结构、分子结构以及晶体结构等知识的考查;显然,不论是元素推断还是各选项的正误判断均离不开质子、电子、原子、分子等微粒观。
例2.(2011新课标全国高考13)短周期元素W、X、Y和Z的原子序数依次增大。元素W是制备一种高效电池的重要材料,X原子的最外层电子数是内层电子数的2倍,元素Y是地壳中含量最丰富的金属元素,Z原子的最外层电子数是其电子层数的2倍。下列说法错误的是(
A.元素W、X的氯化物中,各原子均满足8电子的稳定结构
B.元素X与氢形成的原子比为1∶1的化合物有很多种
C.元素Y的单质与氢氧化钠溶液或盐酸反应均有氢气生成
D.元素Z可与元素X形成共价化合物XZ2
解析:推断X、Z两元素需熟悉原子核外电子排布特征,X原子的最外层电子数是内层电子数的2倍,说明X是碳元素;因为W的原子序数小于X,又是制备一种高效电池的重要材料,说明W是金属Li;Z原子的最外层电子数是其电子层数的2倍,短周期元素电子层数最多是3层,Z可能是He、C和S;因为Z的原子序数大于Y,Y又是地壳中含量最丰富的金属Al,所以Z只能是S元素。选项A中W、X的氯化物分别是LiCl和CCl4,显然锂原子不能满足8电子的稳定结构,不正确;X(碳)原子与氢原子形成的原子比为1∶1的化合物可以是C2H2、C6H6或C8H8等,选项B正确;单质铝与氢氧化钠溶液或盐酸反应均有氢气生成,选项C正确;元素Z(S)和元素X(C)均属于非金属元素,二者可以形成共价化合物CS2,选项D正确。
答案:A。
感悟:利用“位、构、性”间的关系来推断元素时,原子核外电子排布特征与元素性质特征往往是解题的突破口,尤其是核外电子这一微粒,经常是解题时必须寻找的“题眼”以及分析题目时必须应用到的知识点,要很好地发挥其应有的解题价值。
例3.(2011新课标全国高考37)氮化硼(BN)是一种重要的功能陶瓷材料。以天然硼砂为起始物,经过一系列反应可以得到BF3和BN,如下图所示:
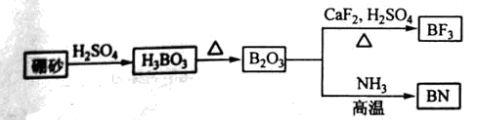
请回答下列问题:
(1)由B2O3制备BF3、BN的化学方程式依次是_________、__________。
(2)基态B原子的电子排布式为_________;B和N相比,电负性较大的是_________,BN中B元素的化合价为_________。
(3)在BF3分子中,F-B-F的键角是_______,B原子的杂化轨道类型为_______,BF3和过量NaF作用可生成NaBF4,BF4—的立体结构为_______。
(4)在与石墨结构相似的六方氮化硼晶体中,层内B原子与N原子之间的化学键为________,层间作用力为________。
(5)六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构与金刚石相似,硬度与金刚石相当,晶胞边长为361.5pm,立方氮化硼晶胞中含有______个氮原子、________个硼原子,立方氮化硼的密度是_______g·cm-3(只要求列算式,不必计算出数值,阿伏伽德罗常数为NA)。
解析:(1)由图示知B2O3与CaF2和H2SO4反应产物之一是BF3,由反应前后原子不变,可以肯定其它产物是硫酸钙和水,故化学方程式为:B2O3+3CaF2+3H2SO4 2BF3↑+3CaSO4+3H2O;同理可得B2O3与氨气反应的化学方程式为:B2O3+2NH3
2BF3↑+3CaSO4+3H2O;同理可得B2O3与氨气反应的化学方程式为:B2O3+2NH3 2BN+3H2O。
2BN+3H2O。
(3) BF3分子为典型的平面正三角形结构,故F-B-F的键角是120°,杂化轨道类型为sp2;B原子最外层只有3个电子,具有空轨道,F—离子可作为配体与BF3分子通过配位键结合形成BF4—离子,由于中心原子B要提供4个等价轨道,只有2个电子层的B原子只能采取sp3杂化,故BF4—的结构为正四面体。
(4)六方氮化硼晶体与石墨结构相似,B、N又均属于非金属元素,且形成的化学键时共用电子对偏向电负性大的N原子,故层内B原子与N原子之间的共价键为是极性共价键;而层与层之间靠分子间作用力结合。
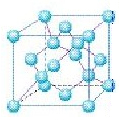
(5)立方氮化硼与金刚石晶胞相似,同是立方体,如图所示:,其中8个顶点有8个碳原子,6个面各有6个碳原子,立方体内部还有4个碳原子,根据分摊法知,金刚石的一个晶胞中含有的碳原子数=8×1/8+6×1/2+4=8,又根据立方氮化硼的化学式BN知,B原子与N原子微粒数比为1∶1,因此立方氮化硼晶胞中含有4个N和4个B原子。由于立方氮化硼的一个晶胞中含有4个N和4个B原子,其质量是4×25g/NA,立方体的体积是(361.5×10-10) cm3,故立方氮化硼的密度是4×25/NA(361.5×10-10)3g·cm-3。
答案:(1)B2O3+3CaF2+3H2SO4 2BF3↑+3CaSO4+3H2O;
2BF3↑+3CaSO4+3H2O;
B2O3+2NH3 2BN+3H2O
2BN+3H2O
(4)共价键(或极性共价键);分子间作用力
感悟:《物质结构与性质》模块的试题多数是拼盘式的。但几乎每一个问题都会涉及到微粒观,学习过程中对微观粒子的认识有一定的难度,但学会后关键在于重视应用微粒观去解决具体问题,有了物质构成的微粒这一化学观念解决物质结构与性质的问题就会感觉不难了。
二、化学反应中的微粒观
物质的变化是构成物质的微粒间结合方式的改变,因此,研究物质的微观结构变化,有助于理解掌握物质变化的本质。如:原子是化学变化中的最小微粒,故任何化学反应中原子种类和原子个数总是不变的。离子反应的本质是反应物中的某些离子浓度减小,所以要从离子变化的角度来认识离子反应规律。氧化还原反应的本质是反应过程中有电子转移,故要从得失电子的角度来认识氧化还原反应规律。
有关离子反应规律的重要考点:①离子共存问题的考查;②考查离子方程式正误判断及原因分析;③考查正确书写各类反应的离子方程式等。
有关氧化还原反应规律的重要考点:①电子守恒规律在配平、计算中的考查;②电化学反应规律的考查等。
例1.(2011江苏高考4)常温下,下列各组离子在指定溶液中一定能大量共存的是(
A.1.0 mol·L-1的KNO3溶液:H+、Fe2+、Cl—、SO42—
B.甲基橙呈红色的溶液:NH4+、Ba2+、[Al(OH)4]—、Cl—
C.pH=12的溶液:K+、Na+、CH3COO—、Br—
D.与铝反应产生大量氢气的溶液:Na+、K+、CO32—、NO3—
解析:离子共存题实际上就是考查离子反应规律。选项A:H+与NO3—构成了具有强氧化性的硝酸,可氧化Fe2+离子,不共存;选项B:甲基橙呈红色的溶液是酸性溶液的,酸性溶液中[Al(OH)4]—不共存,NH4+与[Al(OH)4]—发生互相促进水解反应也不共存;选项D:与铝反应产生大量氢气有两种可能:强酸性或强碱性溶液,强酸性溶液中CO32—不共存;选项C:pH=12的溶液是碱性溶液,与四种离子均可共存,C正确。
答案:C。
感悟:本题以溶液中离子共存的方式考查氧化还原反应规律和离子反应规律(主要是复分解反应规律和水解反应规律),并对硝酸的氧化性、Fe2+离子还原性、NH4+和[Al(OH)4]—离子的水解性、铝与强酸或强碱溶液反应、CO32—离子的弱酸根性质以及溶液呈酸碱性的各种情况判断等相关知识的考查,完全体现了化学反应中的微粒观,可以紧扣各种离子的性质直接解题。
例2.(2011江苏高考6略有改动)下列表示对应化学反应的离子方程式正确的是(
A.FeCl3溶液与Cu的反应:Cu+Fe3+=Cu2++Fe2+
B.NO2与水的反应:3NO2+H2O=2NO3—+NO+2H+
C.醋酸溶液与水垢中的CaCO3反应:CaCO3+2H+=Ca2++H2O+CO2↑
D.向Na[Al(OH)4]溶液中通入过量CO2:
2[Al(OH)4]—+CO2=2Al(OH)3↓+CO32—+H2O
解析:离子方程式要注意三守恒(元素、电子、电荷),选项A电荷不守恒(得失电子也不守恒),正确的方程式是:Cu+2Fe3+=Cu2++2Fe2+;选项B:NO2与水的反应生成强酸硝酸和NO,仅硝酸可拆成离子;选项C用食醋除去水垢涉及到弱电解质醋酸及难溶物质碳酸钙的书写,二者均不能拆成离子,醋酸不能用H+离子表示,正确的方程式是:CaCO3+2CH3COOH=2CH3COO—+Ca2++H2O+CO2↑;选项D:向Na[Al(OH)4]溶液中通入过量CO2的产物是HCO3—离子,而不是CO32—离子,正确的方程式是:[Al(OH)4]—+CO2=Al(OH) 3↓+HCO3—。
答案:B。
感悟:本题对离子方程式正误判断的考查,不仅涉及生活知识,而且涉及元素化合物知识,不仅要注意反应物和生成物的状态、溶解性、氧化性、还原性、强弱酸的电离情况等性质,而且还要注意物质过量时有关离子的反应情况。只要在全面理解各微粒的性质和微粒间的反应规律即可做出正确判断。
例3.(2011安徽高考12)研究人员最近发现了一种“水”电池,这种电池能利用淡水与海水之间含盐量差别进行发电,在海水中电池总反应可表示为:5MnO2+2Ag+2NaCl=Na2Mn5O10+2AgCl,下列“水”电池在海水中放电时的有关说法正确的是(
A.正极反应式:Ag+Cl—-e—=AgCl
B.每生成1 mol Na2Mn5O10转移2 mol电子
C.Na+不断向“水”电池的负极移动
D.AgCl是还原产物
解析:由电池总反应可知银失去电子被氧化为Ag+,银作负极;因电解液中含有NaCl,Ag+与Cl—结合生成AgCl,故产物AgCl是氧化产物,选项A、D都不正确;在原电池中阳离子在正极得电子发生还原反应,所以阳离子向电池的正极移动,选项C错误;根据氧化还原反应电子守恒知,生成1mol Na2Mn5O10得到电子的物质的量一定等于2molAg失去电子的物质的量,即2mol电子;或根据MnO2中Mn元素的化合价是+4价,化合物Na2Mn5O10中Mn元素的化合价是+18/5价,所以每生成1mol Na2Mn5O10得到电子的物质的量为(4-18/5)×5mol=2mol。选项B正确。
答案:B。
感悟:电化学的反应规律万变不离其宗,即氧化还原反应得失电子的规律。当考查定性分析时,要认真分析各电极发生的反应,从得失电子的角度判断氧化还原反应及电化学的有关概念;当考查定量计算时,要在分析得失电子的基础上,利用电子守恒进行快速解题。
三、物质在水溶液中的微粒观
任何物质的水溶液中,一定同时有H+、OH—离子和H2O分子,电解质在这些微粒作用下其组成发生改变。如:强电解质在水的作用下发生完全电离,全部转化为离子;弱电解质在水的作用下发生部分电离,部分转化为离子;可水解的盐在水中发生水解,破坏了水的电离平衡;难溶电解质在水中溶解产生离子,存在着沉淀溶解平衡。这些物质的水溶液中都存在离子、分子等微粒,因此,解决这类化学问题时离不开微粒的观点。
例1.(2011江苏高考14)下列有关电解质溶液中微粒的物质的量浓度关系正确的是(
A.在0.1 mol·L-1NaHCO3溶液中:c(Na+)>c(HCO3—)>c(CO32—)>c(H2CO3)
B.在0.1 mol·L-1Na2CO3溶液中:c(OH—)-c(H+)=c(HCO3—)+2c(H2CO3)
C.向0.2 mol·L-1NaHCO3溶液中加入等体积0.1mol·L-1NaOH溶液: c(CO32—)>c(HCO3—)>c(OH—)>c(H+)
D.常温下,CH3COONa和CH3COOH混合溶液[pH=7,c(Na+)=0.1 mol·L-1]:c(Na+)=c(CH3COO—)>c(CH3COOH)>c(H+)=c(OH—)
解析:本题纯属水溶液中离子浓度大小比较、水解平衡与电离平衡、电荷守恒、物料守恒和质子守恒等知识的全面考查。选项A:HCO3—离子在溶液中存在水解与电离两个平衡,说明c(Na+)>c(HCO3—),溶液呈碱性说明水解过程大于电离过程,即c(H2CO3)>c(CO32—),不正确;选项B:c(OH—)-c(H+)=c(HCO3—)+2c(H2CO3),把c(H+)移项到等式另一边,即是质子守恒关系式,正确。选项C:向0.2 mol·L-1NaHCO3溶液中加入等体积0.1 mol·L-1NaOH溶液后,相当于0.05 mol·L-1的Na2CO3溶液和0.05 mol·L-1NaHCO3溶液的混合液,由于CO32—离子的水解程度大于HCO3—离子的水解程度,说明c(HCO3—)>c(CO32—)>c(OH—)>c(H+),不正确。选项D:常温下,在CH3COONa和CH3COOH的混合溶液中,存在CH3COO—水解和CH3COOH电离两个过程,题设pH=7,则c(H+)=c(OH—)=1×10-7mol·L-1;根据电荷守恒式,不难得出c(Na+)=c(CH3COO—)=0.1 mol·L-1,又因为CH3COOH的电离程度大于CH3COO—离子的水解程度,c(CH3COO—)>c(CH3COOH),正确。
答案:BD。
感悟:溶液中离子浓度大小比较的考查,是考试热点内容,涉及的知识较多,也容易失误,要紧扣一个不等式(离子浓度大小关系)、两个关键(电离平衡、水解平衡)、三个守恒式(电荷守恒、物料守恒、质子守恒)进行全面分析,大作微粒文章,确保解题顺畅。
例2.(2011天津高考5)下列说法正确的是(
A.25℃时NH4Cl溶液的KW大于100℃时NH4Cl溶液的KW
B.SO2通入碘水中,反应的离子方程式为SO2+I2+2H2O=SO32—+2I—+4H+
C.加入铝粉能产生氢气的溶液中,可能存在大量的Na+、Ba2+、[Al(OH)4]—、NO3—
D.100℃时,将pH=2的盐酸与pH=12的NaOH溶液等体积混合,溶液显中性
解析:在稀溶液中水的离子积常数KW=c(H+)·c(OH—),KW只与温度有关而与溶液的酸碱性无关,因水的电离是吸热的,所以温度升高时促进水的电离,KW增大,25℃时KW=1×10-14,100℃时KW=1×10-12,所以选项A不正确。选项B不满足氧化还原反应的电子守恒和质量守恒(方程式中氧原子不守恒)错误,碘水具有氧化性,可以将二氧化硫氧化成硫酸,而单质碘被还原成碘离子,正确的方程式为SO2+I2+2H2O=SO42—+2I—+4H+。能和铝粉反应产生氢气的溶液既可以显酸性也可以显碱性,在酸性溶液中:[Al(OH)4]—会结合H+生成氢氧化铝沉淀或生成Al3+,或H+、NO3—共存时铝粉反应不产生氢气,故[Al(OH)4]—、NO3—不能大量共存;但四种离子:Na+、Ba2+、[Al(OH)4]—、NO3—可以在碱性溶液中大量共存,选项C正确。100℃时,KW=1×10-12,pH=2的盐酸中c(H+)=10-2mol·L-1,而pH=12的NaOH溶液中c(OH—)=1 mol·L-1,所以当二者等体积混合时NaOH过量,溶液显碱性,选项D不正确。
答案:C。
感悟:物质在水溶液中存在着各种离子平衡,这些平衡都是动态的,当外界条件发生变化时,水溶液中的各种微粒的量也在发生变化,必须引起足够的重视。否则,误选就不可避免。
四、化学计算中的微粒观
物质是由微粒构成的,有关物质的量的计算与物质的微粒数计算有着密切关联,结合阿伏伽德罗常数NA来分析判断一定量的物质所含有的某种粒子数目的多少,是高考命题的热点之一。因为这种题型所涉及的知识非常丰富,有基本概念如物质组成、物质状态、物质变化、各化学量等,有基本理论如物质结构(各种粒子的数目、化学键数目、共用电子对数、晶胞的质点数等)、电离、水解等,有元素化合物知识如各种物质发生氧化还原反应或离子反应的微粒分析等,考查面全,综合程度大,灵活性强,应多加注意,强化训练。
化学常常是研究物质组成和物质变化的,有关化学式和化学方程式中均蕴含着各种微粒间的定量关系,根据化学式或化学方程式计算是高考中必考的内容,注意挖掘有关微粒间的定量关系,可以巧妙且准确解决计算问题。
A.1mol甲醇中含有C—H键的数目为4 NA
B.25℃,pH=13的NaOH溶液中含有OH—的数目为0.1 NA
C.标准状况下,2.24L已烷含有分子的数目为0.1 NA
D.常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA
解析:甲醇的结构简式是CH3OH,其中有3个C—H键、1个C—O和1个O—H,故1mol甲醇中含有C—H键的数目为3 NA,选项A不正确;选项B中NaOH溶液体积未知,无法计算OH—的数目;选项C中的标准状况下已烷为液态,气体摩尔体积不适用,无法计算;选项D:Na2O2与足量H2O反应,共生成0.2molO2,氧元素的化合价-1价转变为0价,转移电子的数目为0.2NA×2=0.4NA。
答案:D。
感悟:解答此类题,要理解并灵活应用各种知识,尤其是基本概念与理论中微粒守恒、化学键问题、晶体结构问题、氧化还原中电子转移问题、可逆反应问题及物质的量计算中一些特殊物质的状态等,还要注意破解题设的隐含情况,快速将各量迅速转化为指定粒子的物质的量进行准确判断。
例2.(2011福建高考23)
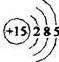
(1)磷元素的原子结构示意图是____________。
(2)磷酸钙与焦炭、石英砂混合,在电炉中加热到1500℃生成白磷,反应为:2Ca3(PO4) 2+6SiO2===6CaSiO3+P4O10
(3)硫代硫酸钠(Na2S2O3)是常用的还原剂。在维生素C(化学式C6H8O6)的水溶液中加入过量I2溶液,使维生素C完全氧化,剩余的I2用Na2S2O3溶液滴定,可测定溶液中维生素C的含量。发生的反应为:C6H8O6+I2===C6H6O6+2H++2I—
(4)在酸性溶液中,碘酸钾(KIO3)和亚硫酸钠可发生如下反应:2IO3—+5SO32—+2H+===I2+5SO42—+H2O,生成的碘可以用淀粉溶液检验,根据反应溶液出现蓝色所需的时间来衡量该反应的速率。某同学设计实验如下表所示:
| 0.01 mol·L-1KIO3酸性溶液(含淀粉)的体积/mL | 0.01 mol·L-1Na2SO3溶液的体积/mL | H2O的体积/mL | 实验温度 /℃ | 溶液出现蓝色时所需时间/s |
实验1 | 5 | V1 | 35 | 25 | |
实验2 | 5 | 5 | 40 | 25 | |
实验3 | 5 | 5 | V2 | 0 | |
II、稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。
(5)铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解,无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
(6)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:
□Ce3++□H2O2+□H2O ===□Ce(OH) 4↓+□_______
解析:(1)P属于第15号元素,其原子的结构示意图为:
(2)每生成1 mol P4时,P元素由+5价变成0价,由分子式P4知电子转移为1 mol×4×5=20mol;或由题设化学方程式知C元素化合价由0价变成为+2价,10molC参与反应恰好生成1 mol P4,电子转移为10mol×2=20mol。
(3)由题设各量与有关化学方程式知:n(Na2S2O3)=bV2/1000 mol,与其反应的I2为bV1/2000 mol,与维生素C反应的I2为(2aV1-bV2)/2000 mol,即维生素C的物质的量是(2aV1-bV2)/2000 mol。
(4)由实验1和实验2可知实验目的是探究该反应速率与亚硫酸钠溶液浓度的关系;由实验2和实验3可知实验目的是探究该反应速率与温度的关系。由实验2可以看出混合液的总体积为50mL,V1为10mL,V2为40mL。
(5)题设加热条件下CeCl3易发生水解,知NH4Cl的作用是肯定是抑制水解,CeCl3水解会生成HCl,故NH4Cl的作用是分解出HCl气体,抑制CeCl3水解。
(6)依题意强酸性或观察方程式借助电荷守恒可知缺项是H+离子,利用电子守恒或观察法可以配平方程式:2Ce3++H2O2+6H2O=== 2Ce(OH)4↓+6H+。
答案:(1)![]()
(4)探究该反应的速率与温度、亚硫酸钠溶液浓度的关系(或其他合理答案)
(5)分解出HCl气体,抑制CeCl3的水解(或其他合理答案)
(6)2Ce3++H2O2+6H2O=== 2Ce(OH)4↓+6H+。
感悟:此题考查原子结构示意图、氧化还原反应的配平与电子转移计算、滴定中有关离子反应的简单计算、水解知识、实验探究变量的控制等,均是高中化学中的主干知识,多数问题与物质的微粒均有连带关系,注意挖掘,方便解题。

- 全部评论(0)
