中学化学微粒观的内涵
时间:2015-11-19 19:22 来源:未知 作者:甑炳杨 点击:次 所属专题: 化学观念 微粒观
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学是在原子、分子水平上研究物质的组成、结构、性质及其应用的一门基础自然科学,其特征是研究分子和创造分子[1]。分子、原子、离子、电子等微观粒子,是化学最基本的研究对象,这些粒子的结合、重组,是构成物质及其物质变化和能量变化的根本原因。微粒观是中学化学的核心观念,是构建学科图景的重要基础。本文拟从中学化学微粒观的内涵、教育价值和构建策略三个方面,试谈中学化学微粒观的构建。
1.微粒的构成观
描述物质组成时,从宏观角度描述,物质是由元素组成的,从微观角度描述,物质是由原子、分子、离子构成的。元素是具有相同核电荷数(即质子数)的同一类原子的总称。同种元素可能含有不同的中子,如:H、D、T,可能含有不同的中子和电子,如:H、D、T+,可能含有不同的电子,如Na、Na+。元素属宏观概念,只论种类,不论个数。元素有两种存在形态,即游离态(存在于单质中)和化合态(存在于化合物中)。物质的组成可用下图表示:
宏观物质都是由微观粒子构成的,构成物质的微观粒子是多种多样的
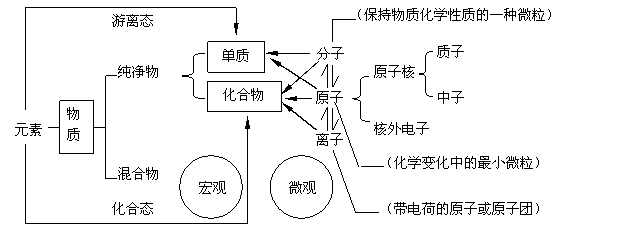
而且是有层次的,微粒的构成观是微粒观的基础。一个具有微粒的构成观的人与他人的区别,就在于他观察和感知宏观物质的性质时,能透过宏观物质性质的表象,思维的潜意识里自然会勾勒出微观粒子的构成图。
2.微粒的间隙观
等体积的酒精和水混合后溶液体积不等于两者之和,而是减小;温度升高,气体体积变大,压强增大,气体体积减小,等等。这些现象都说明了分子间隙的存在。在分子内部,当原子核与核外电子吸引力以及核与核、电子与电子斥力达到平衡时,形成化学键的原子核间距保持一定,这就是键长。在原子晶体中,原子间通过具有方向性和饱和性的共价键构成晶体,使得晶体内部形成具有特定几何构型的空隙;金属晶体、离子晶体和分子晶体,尽可能采用密堆积结构,不同的堆积方式其空间利用率也不相同。由于分子内的原子间和原子晶体中的原子间是刚性的化学键,金属晶体、离子晶体和分子晶体采用密堆积结构,因此分子和晶体是不可压缩的。而气体分子间距离相对于分子本身要大得多,分子间又是弱的范德华力,因此气体的体积显著受温度和压强影响。自然和生活现象以及实验事实都证明了微粒间隙的客观存在。
3.微粒的运动观
我们把一滴墨水滴入水中可通过分子的自由扩散得到均一稳定的溶液;通过显微镜可观察到胶体中的花粉无规则运动轨迹(布朗运动),生活中的很多现象都直观地说明了分子的热运动。
现代结构理论和现代实验手段揭示了原子核外电子运动状态和规律:电子运动分能层、能级、原子轨道、自旋等。电子吸收光子就会跃迁到能量较高的激发态,反过来,激发态的电子会放出光子,返回到基态或能量较低的激发态,电子的跃迁规则,解释了焰色反应本质和原子光谱确定恒星大气中存在什么元素的原理。
在有机物分子中,组成化学键或官能团的原子处于不断振动的状态(伸缩振动—改变键长;弯曲振动—改变键角),其振动频率与红外光的振动频率相当。所以,当用红外线照射有机物分子时,不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同的位置,从而获得分子中含有何种化学键或官能团的信息。
运动是物质世界的本质属性。显然,微粒的运动状态与能量变化相伴随。
4.微粒的作用观
物质的性质不仅取决于构成物质微粒的种类,还决定于微粒间的相互作用。一定种类和数量的微观粒子之间通过相互作用按照特定的方式结合才构成特定的物质。微粒间主要的和强烈的相互作用就是化学键,这是微粒构成物质的根本原因。此外,微粒间还存在相对较弱的作用,如分子间作用力、氢键,它们和化学键一起,共同决定和影响着物质的性质。
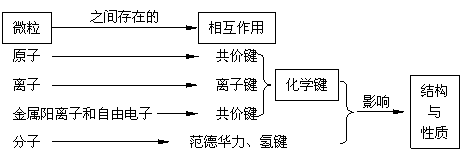
以晶体为例,不同类别的晶体特征性质主要取决于构成晶体的微粒种类及其微粒间的作用力。
晶体类型 | 金属晶体 | 离子晶体 | 原子晶体 | 分子晶体 | |
结 构 | 构成微粒 | 金属阳离子和自由电子 | 阴、阳离子 | 原子 | 分子 |
微粒间 作用力 | 金属键 | 离子键 | 共价键 | 分子间作用力 | |
性 质 | 熔、沸点 | 随金属键强弱变化,差别较大 | 较高 | 很高 | 较低 |
随金属键强弱变化,差别较大 | 较大 | 很大 | 较小 | ||
导电性 | 良好 | 水溶液和熔融状态能导电 | 一般不导电 | 一般不导电 | |
分子能聚集形成晶体,说明分子间有作用力存在,而分子晶体熔点和沸点均较低,说明分子间作用力是一种较弱的作用力,分子晶体的状态变化仅改变分子间作用力这一层次的微粒作用,而并未破坏分子内原子间的化学键,这就解释了为什么N2的键能很大,而其熔点和沸点却很低的困惑。
同一类型微粒间的相互作用还受一定的因素影响,而呈现规律性的变化。例如,同为钾型堆积(体心立方晶胞)的碱金属晶体,其金属键随碱金属原子(离子)半径增大而减弱,因而其熔点和沸点逐渐降低。对于结构和组成相似的分子晶体,其分子间作用力一般随相对分子质量增大而增强,因而卤素的熔点和沸点逐渐升高,这一变化结论与碱金属正好相反。教学实践中学生常常将这两个结论混同,正暴露出学生微粒作用观的薄弱。
5.微粒的能量观
化学反应的本质是粒子的分合重组,物质一旦发生了化学变化,其微观结构及至微观组成就改变了,微观粒子的相互作用也就改变了,这种微观组成、结构、微粒间相互作用的方式等的改变决定了化学反应是从环境中吸收能量,还是往环境中释放能量。
化学键与化学反应中能量变化的关系如下:
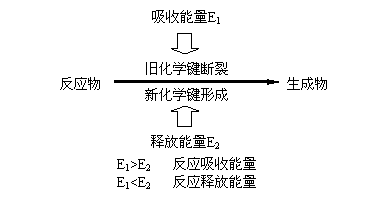
因此,可通过键能估算反应热,也可由反应热推算键能。
一定条件下宏观物质体系的能量是一定的,正是由于该条件下微观组成、结构、微粒间相互作用一定,化学反应中的能量变化,也反映了反应前后物质体系总能量(焓)高低变化:
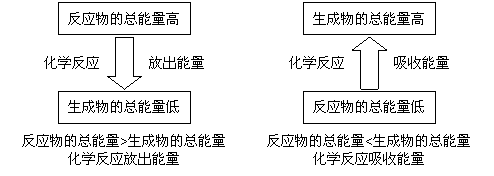
核裂变和核聚变,则反映了原子核内部微粒作用力变化引起的能量变化。
6.微粒的空间观
分子的构成不仅有特定的原子和化学键,键角参数还决定了分子的几何结构,因此多原子分子具有丰富多样的空间构型。如:



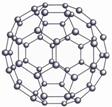
H2O CO2 CH4 C60
普遍存在的有机分子异构现象(包括构造异构、立体异构、对映异构)更是充分展示了分子空间构型的多样性和丰富性。
规则的晶体外观实际上是其内部微观粒子有序排列的宏观表现,人们借用晶胞概念描述晶体内部微观粒子的空间分布。例如:
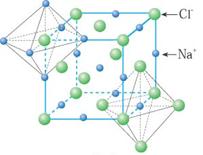
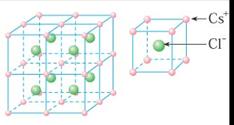
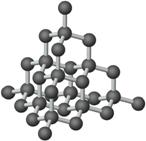
NaCl CsCl 金刚石
在由无方向的金属键力、离子键力和范德华力等结合的晶体中,原子、离子和分子等微粒总是趋向于相互配位数高,能充分利用空间的堆积密度大的那些结构,从而可使体系的势能尽可能降低,结构稳定。晶体结构的密堆积原理揭示了晶体内部微观粒子的空间分布与体系稳定性的关系。
金属晶体的堆积模型

简单立方 钾型 镁型 铜型
微观粒子特定的空间分布反映了物质世界的秩序和规范、精美和多姿。

- 全部评论(0)
(1683097460) 评论 中学化学微粒观的内涵:讲的好好!!
