常见晶体结构特点
时间:2016-01-30 15:10 来源:未知 作者:罗云峰 点击:次 所属专题: 晶体结构
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
金刚石晶体
①金刚石中每个C原子以sp3杂化,分别与4个相邻的C 原子形成4个σ键,故键角为109°28′,每个C原子的配位数为4;
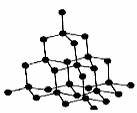
②每个C原子均可与相邻的4个C构成实心的正四面体,向空间无限延伸得到立体网状的金刚石晶体,在一个小正四面体中平均含有1 4×1/4 =2个碳原子;
③在金刚石中最小的环是六元环,1个环中平均含有6×1/12=1/2个C原子,含C-C键数为 6×1/6=1;
④金刚石的晶胞中含有C原子为8个,内含4个小正四面体,含有 C-C键数为16。
二氧化硅晶体
①二氧化硅中Si原子均以sp3杂化,分别与4个O原子成键,每个O原子与2个Si原子成键;
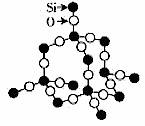
②晶体中的最小环为十二元环,其中有6个Si原子和6个O原子,含有12个Si-O键;每个Si原子被12个十二元环共有,每个O原子被6个十二元环共有,每个Si-O键被6个十二元环共有;每个十二元环所拥有的Si原子数为6×1/6=1,拥有的O原子数为6×1/6=1,拥有的Si-O键数为12×1/6=2,则Si原子数与O原子数之比为1:2。
石墨

石墨的层状结构
(1)石墨中C原子以sp2杂化;
(2)石墨晶体中最小环为(6)元环,含有C(2)个,C-C键为(3);
(3)石墨分层,层间为范德华力,硬度小,可导电;
(4)石墨中r(C-C)比金刚石中r(C-C)短。
(责任编辑:化学自习室)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
