发烟硫酸稀释计算
时间:2025-08-07 15:08 来源:未知 作者:黄晓东 点击:次 所属专题: 浓硫酸稀释
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
[例]现有1L 含SO3为30%的发烟硫酸(密度为1.95g/cm3),要把它稀释成为95%的浓硫酸。求需要往其中加入水的体积。
[分析]学生对“含SO3为30%的发烟硫酸”的意义不太明确。同时,水的密度为1g/cm3,也是隐含的条件,1L 中单位“L”与密度中的单位“cm3”不一致,要换算。没有提示时,很多学生以为30%为SO3,70%为水,结果当然错误;当提示含SO3为30%的发烟硫酸是30%的是SO3,70%的为纯硫酸后,全班也只有10%的同学能解答。为了讲清楚此题,我先用分步计算法讲解,再用稀释规律讲解。从多个角度解析。讲解后90%的同学能够听懂,收到了较好的效果。
[解法一]分步计算法
设发烟硫酸中30%的三氧化硫转化为硫酸时需要水的质量为X,同时生成硫酸的质量为Y。则
SO3+H2O==H2SO4
801898
1000×1.95×30% x y
解得:x=132g,y=717g
30%的三氧化硫转化为硫酸时,纯硫酸的质量共为1950+132=2082g
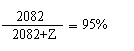
再设还需加水的质量z时,纯硫酸可变为95%的浓硫酸,则有z=110g
故共加水132+110=242g,因为水的密度为1g/cm3,即加入水的体积为242mL
[解法二]稀释规律法
设加水的质量为x,根据稀释前后硫酸的质量不变,则有
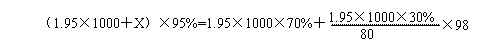
解得:x=242(g),即加入水的体积为242mL。
(责任编辑:)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
