反应热和键能的关系
时间:2018-10-08 20:57 来源:未知 作者:张珍艳 点击:次 所属专题: 键能 反应热计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在化学反应中,从反应物分子转变为生成物分子,各原子内部并没有多少变化,但原子间的结合方式发生了改变。在这个过程中,反应物分子中的化学键部分或全部遭到破坏,生成物分子中的新化学键形成。实验证明,在破坏旧化学键时,需要能量来克服原子间的相互吸引;在形成新化学键时,由于原子间的相互吸引而放出能量。化学反应的反应热就来源于旧化学键的破坏和新化学键的形成所发生的能量变化。
化学键是分子中相邻原子间的强烈的相互作用,这种相互作用具有一定的能量,这一能量就是键能。键能常用E表示,单位是kJ/mol。
下面用乙烷裂解为乙烯和氢气为例,根据化学反应中化学键的改变和键能的变化来分析反应热和键能的关系。
在乙烷分子中,原子间的结合力可归结为6个C—H键和1个C—C键:
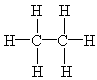
在乙烯分子中,原子间的结合力可归结为4个C—H键和1个C=C键:
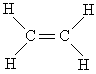
从键能数据估算反应热的具体方法和步骤如下:
(1)写出反应的化学方程式,并突出反应物和生成物分子中的各个化学键。
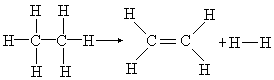
(2)归纳出化学键改变的情况。
6C—H + C—C → 4C—H + C==C + H—H
即:2C—H + C—C → C==C + H—H
(3)从键能的表中,查出有关的数据。
E(C—H)=414.4 kJ/mol;E(C==C)=615.3 kJ/mol;E(C—C)=347.4 kJ/mol;E(H—H)=435.3 kJ/mol
(4)根据下列公式粗略地估计反应热(Q)。
ΔH=∑E(反应物)-∑E(生成物)
上式表明,反应热等于生成物的键能总和跟反应物的键能总和之差。
ΔH=[2E(C—H)+E(C—C)]-([E(C==C)+E(H—H)]=(2×414.4+347.4)kJ/mol-(615.3+435.3)kJ/mol==125.6 kJ/mol
这表明,上述反应是吸热的,吸收的热量为125.6kJ/mol。
其他反应是吸热还是放热,数值是多少,可以用以上方法进行估计。

- 全部评论(0)
