为什么自然界没有游离态的硅
时间:2012-07-21 17:15 来源:未知 作者:张超鹏 点击:次 所属专题: 硅元素
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
疑问:教材[1]146页第一自然段第二行:“在常温下,硅的化学性质不活泼,……”;145页第二节第一自然段第二行:“在自然界中,没有游离的硅,只有以化合态存在的硅,……”;既然在常温下,硅的化学性质不活泼,为什么自然界中没有游离态的硅单质?
回答:
基态时,硅的原子电子组态为:Si:[Ne] 3s23p2,硅原子价层3s、3p轨道有电子占据,能级相近的3d空轨道可以参加成键作用,因d轨道参加成键,除形成sp3d和sp3d2等杂化轨道外,还使Si—O等类型化学键因pπ-dπ作用而大大增强[2]。
键 | 键长/pm | 键能/(kJ·mol-1) | 键 | 键长/pm | 键能/(kJ·mol-1) |
Si—Si | 235 | 226 | Si—O | 166 | 452 |
由表1可以看出键能(E)的关系:E(Si—O)>> E(Si—Si)
自然界中硅的主要存在形式硅酸盐,主要是以[SiO4]4-基团组成,在[SiO4]4-基团中,Si除以sp3杂化轨道和4个氧原子按四面体方向形成4个σ键外,Si原子的dx2-y2和O原子的p轨道相互叠加,由O原子提供电子成键,如图1(a)所示,同时Si原子的dz2轨道也可和O原子的pπ轨道互相叠加,由O原子提供电子成键,如图1(b)所示。由于这种pπ→dπ的作用,使Si—O键增强,键长缩短,键能增加。在硅酸盐中, Si—O键的平均键长为162pm,它比和的共价单键半径和(113pm+77pm=190pm)短28pm[2]。
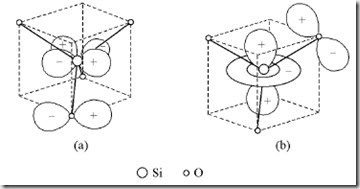
图
(a)pπ→dx2-y2,(b) pπ→dz2,注:引自文献[2]。
在地壳形成时温度很高,且硅与氧具有高亲和力[3],能够生成更为稳定的Si—O四面体结构,因此,丰度仅次于氧的硅单质在自然界中就并不存在了,即自然界中不存在由Si—Si键连接的纯硅单质,而是基本上是以更为稳定的Si—O键结合的硅酸盐的形式存在[2]。
参考文献:
[1] 人民教育出版社化学室.全日制普通高级中学教科书(必修)化学第一册[M],北京:人民教育出版社,2003:145-146
[2] 周公度.碳和硅结构化学的比较[J] .大学化学,2005,20(4):1-3
[3] [英]C·A·皮尔斯.华东师范大学化学系翻译组译,硅化学及其应用[M],上海:上海教育出版社, 1984:6
[4] 白涛,魏群等.对“硅”教学中几个疑问的探讨[J],化学教学,2008,(3)

- 全部评论(0)
