常见气体的实验室制备的多种方法归纳
时间:2014-11-20 09:09 来源:未知 作者:陈博殷 点击:次 所属专题: 气体制备 实验室制取
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、制备氢气
1.一般用活泼金属与非氧化性酸反应制备
如用锌、铁、镁、铝等与稀硫酸或盐酸反应制取。反应通式为:M+nH+=Mn++n/2
H2↑。
2.直流电电解稀硫酸或氢氧化钠溶液(即电解水)。
反应式为:2H2O 2H2+O2
2H2+O2
3.碱金属等极活泼金属与水反应。如2Na+2H2O=2NaOH+H2↑。
4.铝等两性金属与碱反应。2Al+2NaOH+2H2O
=2NaAlO2+3H2↑。
5.硅与强碱反应。Si+2NaOH+H2O
=Na2SiO3+2H2↑
二、制备氧气
1.加热高锰酸钾法:
2KMnO4![]() K2MnO4+MnO2+O2↑。
K2MnO4+MnO2+O2↑。
2.氯酸钾催化加热法:
2KClO3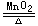 2KCl+3O2↑。
2KCl+3O2↑。
3.过氧化氢催化分解法:
2H2O2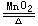 2H2O+O2↑。
2H2O+O2↑。
4.直流电电解稀硫酸或氢氧化钠溶液(即电解水)。
5.过氧化钠与水或二氧化碳反应:
2Na2O2+2H2O==4NaOH+O2↑,2Na2O2+2CO2=2Na2CO3+O2。
三、制备氯气
1.浓盐酸与二氧化锰加热反应:
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2.上述方法中的浓盐酸用氯化钠和浓硫酸替代。反应式可以分步写,也可以写总反应式。
NaCl+H2SO4==NaHSO4+2HCl,
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
2NaCl+2H2SO4+
MnO2![]() Na2SO4+MnSO4++Cl2↑+2H2O
Na2SO4+MnSO4++Cl2↑+2H2O
3.方法1中的氧化剂用高锰酸钾、重铬酸钾、氯酸钾、次氯酸钙等氧化剂代替制备。
2KMnO4+16
HCl==2 KCl+2 MnCl2+5 Cl2↑+8 H2O,
K2Cr2O7+14HCl==
2KCl+2CrCl3+ 3Cl2↑+7 H2O,
KClO3+6 HCl== KCl+
Cl2↑+3
H2O,
Ca(ClO)2+2HCl(浓)=CaCl2+
Cl2↑+
H2O
四、制备氨气
1.氯化铵固体与氢氧化钙固体加热制取:
2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
2.浓氨水加热法:
NH3·H2O![]() NH3↑+H2O
NH3↑+H2O
3.浓氨水与固体烧碱或生石灰混合制取,固体烧碱或生石灰能吸水同时放热,促使氨水的分解和氨的挥发。烧碱或生石灰溶于水,溶液中氢氧根离子浓度增大,也有利氨气的逸出。
五、制备氯化氢气
1.金属氯化物与浓硫酸加热反应:
如2NaCl+H2SO4![]() Na2SO4+2HCl↑,
Na2SO4+2HCl↑,
2.浓盐酸加热法。
3.浓盐酸滴入浓硫酸中制备。浓硫酸有强吸水性,并在吸水时放大量的热,使浓盐酸中的氯化氢挥发出来。

- 全部评论(0)
