有机化合物的燃烧规律及例题解析
时间:2012-11-23 16:10 来源:未知 作者:周四 点击:次 所属专题: 有机化学规律 有机物燃烧规律
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
做有关有机物燃烧的试题时,其根本依据是有机物燃烧的通式:
烃:
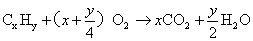
烃的衍生物:
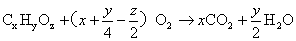
若题中明确给出了烃或烃的衍生物的类别,上面的燃烧通式还可进一步简化,如烷烃的燃烧:
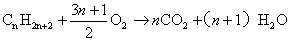
一.质量一定时有机物完全燃烧的耗氧量规律
烃类物质(CxHy)完全燃烧的耗氧量与y/x成正比。
有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中含碳或氢的质量分数一定;若混合物总质量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的物质的量保持不变,则混合物中各组分含碳或氢的质量分数相同。
燃烧时耗氧量相同,则两者的关系为:(1)同分异构体 或(2)最简式相同
例题1.下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是
A.甲烷、辛醛B.乙炔、苯乙烯C.甲醛、甲酸甲酯D.苯、甲苯
例题解析:混合物总质量一定,不论按什么比例混合,完全燃烧后生成CO2的质量保持不变,要求混合物中各分组含碳的质量分数相同。B、C中的两组物质的最简式相同,碳的质量分数相同,A中碳的质量分数也相同,所以答案为D。
二.物质的量一定时有机物完全燃烧的耗氧量规律
比较判断耗氧量的方法步聚:
①.若属于烃类物质,根据分子中碳、氢原子个数越多,耗氧量越多直接比较;若碳、氢原子数都不同且一多一少,则其耗氧量的大小取决于
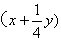 值的大小,该值越大,耗氧量越多。
值的大小,该值越大,耗氧量越多。②.若属于烃的含氧衍生物,先将分子中的氧原子结合氢或碳改写成H2O或CO2的形式,即将含氧衍生物改写为CxHy·(H2O)n或CxHy·(CO2)m或CxHy·(H2O)n·(CO2)m形式,再按①比较CxHy的耗氧量。
有机物完全燃烧时生成的CO2或H2O的物质的量一定,则有机物中碳原子或氢原子的个数一定;若混合物总物质的量一定,不论按何种比例混合,完全燃烧后生成的CO2或H2O的量保持不变,则混合物中各组分中碳或氢原子的个数相同。
例题2.有机物A、B只可能烃或烃的含氧衍生物,等物质的量的A和B完全燃烧时,消耗氧气的量相等,则A和B的分子量相差不可能为(n为正整数)
A.8n B.14n C.18n D.44n
例题解析:A中的一个碳原子被B中的四个氢原子代替,A和B的分子量相差8的倍数,即答案A。 如果A和B的分子组成相差若干个H2O或CO2,耗氧量也不变,即分别对应答案C和D。故相差不可能的应为B。
三.一定量的有机物完全燃烧,生成的CO2和消耗的O2的物质的量之比一定时
生成的CO2的物质的量小于消耗的O2的物质的量的情况:符合通式CxHy·(H2O)m
生成的CO2的物质的量等于消耗的O2的物质的量的情况:符合通式Cn·(H2O)m
生成的CO2的物质的量大于消耗的O2的物质的量的情况
①.若CO2和O2体积比为4∶3,其通式为(C2O)n·(H2O)m
②.若CO2和O2体积比为2∶1,其通式为(CO)n·(H2O)m
例题3.某有机物的蒸气完全燃烧时,需要三倍于其体积的O2,产生二倍于其体积的CO2,则该有机物可能是(体积在同温同压下测定)
A.C2H4B. C2H5OH C.CH3CHO D.CH3COOH
例题解析:产生的CO2与耗氧量的体积比为2∶3,设该有机物为1 mol,则含2 mol的C原子,完全燃烧时只能消耗2 mol的氧气,剩余的1 mol氧气必须由氢原子消耗,所以氢原子为4 mol,即该有机物可以是A,从耗氧量相当的原则可知B也正确。答案为A、B。
四.有机物完全燃烧时生成的CO2和H2O的物质的量之比一定时
有机物完全燃烧时,若生成的CO2和H2O的物质的量之比为a:b,则该有机物中碳、氢原子的个数比为a:2b,该有机物是否存在氧原子,有几个氧原子,还要结合燃烧时的耗氧量或该物质的摩尔质量等其他条件才能确定。
例题4.某有机物在氧气中充分燃烧,生成的水蒸气和二氧化碳的物质的量之比为1:1,由此可以得出的结论是
A.该有机物分子中C:H:O原子个数比为1:2:1
B.分子中C:H原子个数比为1:2
C.有机物必定含O
D.无法判断有机物是否含O
例题解析:根据有机物燃烧规律,若生成的CO2和H2O的物质的量之比为a:b,则该有机物中碳、氢原子的个数比为a:2b,不难判断出B是正确;因题干中未给出实际耗氧量值或该有机物的摩尔质量,因此无法判断该有机物是否含O。答案为:B、D
五.有机物完全燃烧前后气体体积的变化规律
气态烃(CxHy)在100℃及其以上温度完全燃烧时气体体积变化规律与氢原子个数有关
①.若 y = 4,燃烧前后体积不变,△V=0
②.若 y > 4,燃烧前后体积增大,△V=
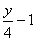
③.若 y < 4,燃烧前后体积减少,△V=
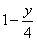
气态烃(CxHy)完全燃烧后恢复到常温常压时气体体积的变化直接用烃类物质燃烧的通式通过差量法确定即可。
液态有机物(大多数烃的衍生物及碳原子数大于4的烃)的燃烧,如果燃烧后水为液态,则燃烧前后气体体积的变化为:氢原子的耗氧量减去有机物本身提供的氧原子数的二分之一。
例题5.120℃时,1体积某烃和4体积O2混和,完全燃烧后恢复到原来的温度,压强体积不变,该烃分子式中所含的碳原子数不可能是( )
A.1 B.2 C.3 D.4
例题解析:要使反应前后压强体积不变,只要氢原子个数可以等于4并保证能使1体积该烃能在4体积氧气里完全燃烧即可。答案为:D
六.有机物分子组成中氢原子数的确定规律
通过比较各类有机物的分子组成,在碳原子数相同的条件下,跟烷烃中的氢原子数比较,有以下规律:
分子结构中有一个双键(无论是碳碳双键还是其他双键),应减少两个氢原子。
分子结构中有一个环,应减少两个氢原子。
分子结构中有一个叁键,应减少四个氢原子。
分子结构中有一个卤原子(x),应减去一个氢原子。
分子结构中有氧原子或硫原子(非双键氧或硫原子),不加不减氢原子。
分子结构中有一个氮原子(非双键、叁键氮原子),则加上一个氢原子。
例如:苯的分子中有6个碳原子,其结构中有一个环,还有相当于双键三个,在烷烃氢原子的基础上共应减去8个氢原子,故分子式为C6H6。
又如:苯分子中的一个碳原子被氮原子代替,只有五个碳原子,在烷烃的基础上,氢原子数应是4个,由于多出1个氮原子,应再加上1个氢原子,故其分子式是C5H5N。
综上所述:在学习与有机物燃烧有关的知识点时要熟记有机物燃烧通式,这是解题的根本依据,在平时做题时要根据以上六类规律勤加总结,在考试时,灵活运用,就可解题成功。

- 全部评论(0)
