化学能与热能的关系
时间:2021-09-05 08:34 来源:未知 作者:江已舒 点击: 次 所属专题: 化学能 热能
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
物质内部都储存着能量,即内能。前述“反应物的能量”或“生成物的能量”指的就是相关物质的内能。发生化学反应时,这些内能部分释放。
物质在化学反应中释放(或补充)的能量称为化学能。化学能其实就是反应物总能量与生成物总能量的差值。当化学能以热能形式释放或补充时,对应的热量变化叫做反应的热效应。热效应为零的巧事几乎不能找到。
化学反应的过程是:断开旧键(使原分子拆分为原子或者离子)然后形成新键(原子或离子形成新的分子)。反应过程的能量改变为:断键吸收能量,从而使整个体系能量升高,继而形成新键释放能量从而使体系能量降低,整个过程可以表示为:
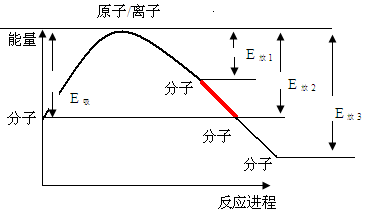
反应拆键所需能量为E吸,合键释放能量为E放,则化学反应过程能量改变为E吸—E放。
化学反应过程的能量改变(反应是吸热还是放热反应)是由断键过程吸收的总能量与合键过程的总能量共同确定的,与反应类型无关;但大多数化合、氧化还原、复分解、置换属于放热变化;分解反应大部分属于吸热过程。这只能说算是一种巧合,没有必然联系。
同样道理是否加热也不是判断反应吸热还是放热的依据
溶解过程大部分可以看做分子拆为离子过程,因此大部分属于吸热过程。
(责任编辑:)

说点什么吧
- 全部评论(0)
还没有评论,快来抢沙发吧!
