共价键与离子键辨析
时间:2014-12-06 19:48 来源:未知 作者:王绍红 点击:次 所属专题: 共价键 离子键
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
离子键与共价键的区别
1、离子键和共价键定义不同
阴、阳离子间的静电作用叫做离子键。原子间通过共用电子对形成的相互作用叫共价键。
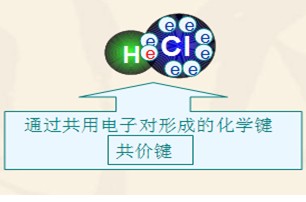
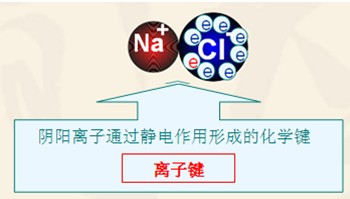
2、离子键和共价键组成元素不同
离子键一般由活泼金属和活泼非金属组成,共价键由非金属与非金属组成,或非金属性较弱的元素与金属性较弱的元素组成,如AlCl3的化学键属于共价键。
3、离子键和共价键形成过程不同
离子键是原子间得、失电子而生成阴、阳离子,然后阴、阳离子通过静电作用而形成的;共价键是原子间通过共用电子对而形成的,原子间没有得失电子,形成的化合物中不存在阴阳离子。
4、离子键和共价键在成键时方向性不同
离子键在成键时没有方向性,而共价键却有方向性。离子键是阴阳离子间通过静电引力形成的化学键。由于阴阳离子的电荷引力分布是球形对称的,一个离子在任何方向都能同样吸引带相反电荷的离子,因此离子键没有方向性。而共价键却大不相同,共价键的形成是成键原子的电子云发生重叠,如果电子云重叠程度越多,两核间电子云密度越大,形成的共价键就越牢固,因此共价键的形成将尽可能地沿着电子云密度最大的方向进行。除s轨道的电子云是球形对称,相互重叠时无方向性外,其余的p、d、f轨道的电子云在空间都具有一定的伸展方向,故成键时都有方向性。
共价键的方向性,决定分子中各原子的空间排布。原子排布对称与否,对于确定分子的极性有重要作用。
5、离子键和共价键在成键时饱和性不同
离子键没有饱和性,而共价键则有饱和性。离子键没有饱和性是指一个离子吸引相反电荷的离子数可超过它的化合价数,但并不意味着吸引任意多的离子。实际上,由于空间效应,一个离子吸引带相反电荷的离子数是一定的。如在食盐晶体中,一个Na+吸引六个Cl-,同时一个Cl-吸引六个Na+。也可以说Na+与Cl-的配位数都是六。
共价键的饱和性,指共价键是通过电子中不成对的电子形成的。一个原子中有几个未成对电子,就可与几个自旋方向相反的电子配对形成几个共价键。成键后,再无未成对电子,也就再不能形成更多的键了。
离子键与共价键的联系
1、离子键与共价键都是静电作用。
2、离子键与共价键没有严格的界限
同种元素形成的共价键,共用电子对处于成键的两个原子中间,是非极性键;不同元素之间形成共价键,当共用电子对稍偏向某个原子,是弱极性键;当共用电子对偏向某个原子很厉害,则是强极性键;当共用电子对彻底偏向某个原子时(即失去电子)则成为离子键。
可以这样理解,离子键和非极性键是共价键的两个极端,极性键则是由非极性键向离子键过渡的中间状态。

- 全部评论(0)
(1251274587) 评论 共价键与离子键辨析:美死你,还打赏
