水解反应的机理和规律
时间:2016-03-24 09:03 来源:未知 作者:章金莲 点击:次 所属专题: 水解反应
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
化学反应中的水解反应,是比较常见的一类反应。许多无机物(如某些盐和非金属卤化物)和有机物(如卤代烃和羧酸的衍生物),都能发生水解反应,现联系中学化学的有关内‘容,浅谈各类物质水解的反应机理和一般规律。
一.、盐类的水解
某些盐发生水解反应的机理,是盐溶于水,产生的酸根离子与水中的氢离子结合生成 了弱酸或易生成气体的酸|或者是盐产生的金属离子(或铵根离子)与水中的氢氧根离子 结合生成了弱碱、或难溶性的氢氧化物(或碱式盐)》引起了水的电离平衡发生了移动的缘故。故此,盐类水解的一般规律:
1 从水解程度看:
(1)与盐的组成有关:强酸弱碱盐、弱酸强碱盐、弱酸弱碱盐,才能水解。
(2 )与水解产物性质有关:水解产物的水溶性越小,或本解产物越难电离,其水解越强烈。
(3 )与温度有关:温度越高,水的离子积(Kw)越大,水解越强烈。
(4 )与溶液浓度有关:对于强酸弱碱盐或弱酸强碱盐,浓度越小,水解越强烈。而对于弱酸弱碱盐的水解,没有影响。
(5 )与溶液酸度有关:溶液呈酸性时,减少酸度,促进永解;溶液呈碱性时,増加 酸度,促进水解。
2、从水解产物看:
盐类水解产物一般是酸和碱,但由于金属离子是分级水解,和金属离子极化力不等,以及生成物的水溶性不同,所以产物有异。一般说来:
I、较低价态金属的盐,常常生成碱式盐。
(1)+ 2、+3价态金属的卤化物、硫酸盐,硝酸盐、醋酸盐
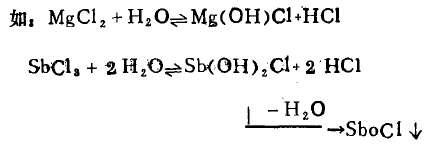
(2 )+ 2价态金属的碳酸盐。
如:2CuCO3 + H2O=Cu2(OH)2CO3+CO2
Ⅱ、较高价态金属的盐,常常生成氧氧化物。
(1)+4价金属的卤化物、硫酸盐、硝酸盐、醋酸盐。
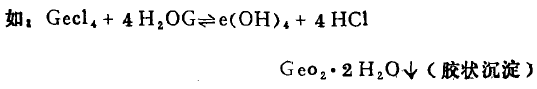
(2 )+3价态金属的碳酸盐。
如:Al2(CO3)3 + 3H2O= 2 Al(OH)3 + 3CO2
至于金属的硫化物,只有少数溶于水并发生水解,其水解产较低价态金属的硫化物(如Na2S, CaS)水解生成酸式盐(如Na2S + H2O NaHS + NaOH)。 较高价态金属的硫化物(为Al2S3,Cr2S3)水解生成氢氧化物(如A12S3+ 6H2O=2Al(OH)3+3H2S)。
NaHS + NaOH)。 较高价态金属的硫化物(为Al2S3,Cr2S3)水解生成氢氧化物(如A12S3+ 6H2O=2Al(OH)3+3H2S)。
二、非金属卤化物的水解
非金属卤化物(RXn)的水解是非金属卤化物(RXn) 和水分子(H2o)配合而引起的。
H2O+BCl3=B(OH)Cl2 + HCl
B(OH)Cl2继续与H2O反应,重复配位和排代:
B(OH)Cl2 + H2O =B( OH)2Cl+ HCl
B(OH)2C1 + H2O=B(OH)3+HCl
故此,非金属卤化物的水解反应的一般规律是:
1、RXn中R有空时价电子轨道时(如BCl3中B有2p空轨道,PCl3,、PCl5、 SiCl4的P, Si中各有3p空轨道,BrF5中Br有4d空轨道),方可和水分子配合,发生水解反应。而没有空轨道的(如CCl4中的C、SF6中的S都没有空轨道),不能和水分子配合,故不能发生水解反应。
2、水解产物一般是含氧酸)和氢卤酸(HX),
3、RXn中,R为成酸元素原子,“假设正离子”(Rn+),其极化力越大,水解越彻底。
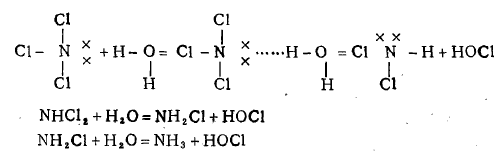
至于NCl3的水解反应,是因为氮原子的价电子层已饱和,没有空的价电子轨道,且 配位数未达最高数,氮原子上一对孤对电子会吸引水分子中的氢原子,而发生水解作用。 其反应机理表达于下:
三、卤代烃的水解
卤代经(RX)的水解是亲核取代反应(SN)。其反应机理是因为卤原子的电性大于碳原子,故卤代烃分子中C一X键具有极性。当遇到极性试剂H2O时,C—X键发生异裂,致使卤原子被水分子中羟基(:OH)取代:
因反应可逆,进行迟缓,故通常是将卤代经和强碱水溶液共热,使反应有利于水解方向进行:
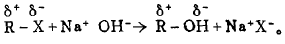
由于卤代烃的结构不同,它们分别发生水解反应的历程不同和离去基团离去的能力不同,所以水解速度也不同。一般规律于下:
1、烃基不同、离去基团相同的卤代径的水解速度。
众所周知,亲核取代反应分为单分子反应历程(SN1 )和双分子反应历程(SN2 ) , 在反应中常常是同时并存,相互竞争。但第一(伯)卤代烃(R-CH2-X)水解,主要 按SN2进行,第三(叔)卤代烃(R3-C-X)水解,主要按SN1进行,第二(仲) 卤代烃(R2-CH-X)水解,按SN1和SN2进行,烯丙式卤代烃(包括CH2 = CCH2-X和C6H5CH2-X)水解,主要按SN1进行,乙烯式卤代径(包括CH2=CH-X和 C6H5-X)不水解。综上所述:
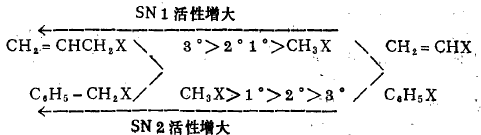
2、烃基相同、离去基团不同的卤代烃的水解速度。
由于C-X键的极化度是: C-I>C-Br>C-Cl,对化学活性起决定作用,故卤代烃水解反应速度是: R-I>R-Br>R-Cl。
四、羧酸衍生物的水解
重要的羧酸衍生物如酰氯(RCOCl )、酸酐(RCOOCOR')、酯(RCOOR')、酰胺(RCONH2〉的水解,绝大多数是酰氧键断裂,双分子反应,在酸性或碱性中进行,是 一个亲核加成一消除历程,
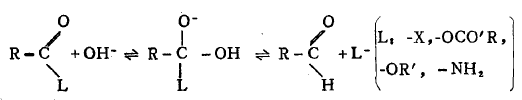
反应首先是亲核试剂OH-进攻,羰基碳发生亲核加成反应,形成中间体,然后失去离去基团,生成产物。
由上可知,反应的难易主要决定于羰基碳与OH-的反应能力,和离去基团脱离碳原子的能力。对于RCOCl来说,Cl的强吸电子作用和较弱的P-π共轭,使羰基碳的正电 性强,易于被OH-进攻;同时-Cl易于离去;故RCOCl的反应活性很高。对于 RCONH2来说,N的吸电子作用较弱和较强的P-π共扼,同时-NH2不易离去;故 RCONH2反应活性较弱。因此上列羧酸衍生物的水解反应进行的难易次序为,RCOCl> RCOOCOR' >RCOOR >RCONH2
另一个规律是上列羧酸衍生物分别与水反应,都是生成相应的酸。

- 全部评论(0)
(1543934373) 评论 水解反应的机理和规律:很好,非常好
MMY(106925583) 评论 水解反应的机理和规律:好!不错不错
