利用“金属活动性顺序”掌握常见金属硫化物的溶解性
时间:2016-03-24 18:30 来源:未知 作者:张澳 点击:次 所属专题: 硫化物 溶解性
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
现行中学化学课本的“酸、碱、盐溶解性”附表中,对碱金属硫化物在水中的溶 解性标有“溶”,对碱土金届和铝等元素的硫化物际有“一”,即这种物质不存在或遇 水就分解了;其它金属元素的硫化物均为“不溶”。但在这些不溶于水的硫化物中, FeS和Zns可溶于稀酸(稀硫酸和稀盐酸,下同),而CuS、PbS等却又可被热的稀硝酸溶解。
在中学化学教学中,金属硫化物的溶解性只是偶尔涉及,不是重点。但学 生在解答与之有关的离子反应、离子方程式的书写,沉淀的生成和转化,盐类的水 解以及氧化一还原反应等问题时,常由于这方面知识的缺欠,导致困惑或错解。为 了解决教学中的这一难点,我们在教学中借助学生所熟悉的“金属活动性顺序”与 对应的硫化物的溶解性制成的金属硫化物溶解性表,让学生记忆硫化物的溶解性, 效果好。
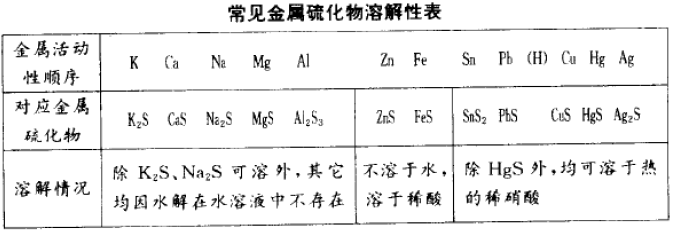
从K〜Al的金属元素所对应的硫化物因溶于水或者发生水解(其实,碱金属硫化物也存在水解,但以溶解为主),这些金属离子遇S2-离子(或H2S)不形成硫化 物沉淀。
ZnS、FeS(Fe3+的硫化物水解)不溶于水,但可溶于稀酸。
Sn〜Ag的硫化物大都可溶干热的稀硝酸中,SnS2、PbS还可溶于浓盐酸,HgS 只溶于王水。故这些金属离子遇到离子(或H2S)时,均生成硫化物沉淀。
能溶于热的稀硝酸的硫化物,主要是由于一 2价的硫元素呈现还原性的缘故,
如:
3CuS+ 8HNO3=3Cu (NO3)2 + 2NO +3S +4 H2O
SnS2、PbS溶于浓盐酸,主要是因为生成了络合物和H2S气体:
PbS+4HCl(浓) = H2S+H2[PbCl4]
HgS溶于王水的反应方程式为:
3HgS+2HNO3 +12HCl = 3H2[HgCl4] + 3S +2NO +4H2O
只要让学生记住T表金属硫比物溶解性规律,即可正确、迅速地对有关间题作 出解答。
例如:将H2S气体分别通入下列四种溶液中,有沉淀出现的是()
(A)FeCl3 (B)稀 H2SO4(C)FeCl2 (D)CuSO4
大多数学生在解此题时易选(C)、(D)或(A)、(C)、(D))而错解。在溶液(A)中, 由于Fe3+的氧化性,使H2S被氧化而析出单质硫:
2FeCl3 + H2S = 2FeCl2 + S+2HCl
(C)和(D)均可生成FeS和CuS沉淀。但由于反应液中有稀HCl和稀H2SO4, FeS可被盐酸溶解,故(C)中看不到沉淀,而(D)中CuS不溶于稀酸,故可肴到黑色沉淀.故正确选项为(A)、(D)。
学生错解的原因一是对Fe3+和负二价硫之间发生的氧化一还原反应不淸楚; 二是学生虽知道FeS和CuS都不溶于水,何却不了解二者在酸中的溶解性,因而造成错解。
因此,利用“金属活动顺序”这一学生熟知的规律,将学生常见的金属硫化物在 水中、酸中的溶解性进行妇纳概括,既易于记忆,又使这方面的知识系统化,弥补了学生知识结构上的缺陷。

- 全部评论(0)
