等电子体的判断方法归纳
时间:2022-11-21 08:41 来源:未知 作者:贺永林 点击: 次 所属专题: 等电子体
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
《四川省普通高中新课程教学基本要求(化学学科)》中对于 “等电子体和等电子原理”有如下描述:(1)了解等电子原理;(2)结 合实例说明“等电子体”具有相似的结构和性质。《2013年四川省 普通高考考试说明(理科综合•化学)》中对“等电子原理”考点是 这样描述的:了解“等电子原理”的含义。
围绕这个考点设计的问题应该是很容易作答的,但学生实际 作答时错误率极高,经分析发现关键在于对等电子体确定上缺乏 方法,对等电子原理的理解不够深人,现就此类问题的分析方法 作如下归纳。
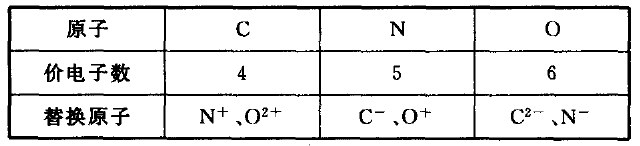
原子总数和价电子总数都相同的分子或离子(即等电子体)具 有相似的化学键特征,它们的许多性质是相近的,这一原理称为 等电子原理。如果仅从概念字面意义上出发去判断与a粒子互为等电子体的b粒子的化学式,往往感觉无从下手,或东拼西凑地 试着写,也往往只注意从“价电子总数”或“原子总数”相同某一方 面而错写。如,写CH4分子的等电子体时许多学生错写成NH3,忽 略原子总数不同)、CCl4(忽略价电子总数不同)等,至于再稍复杂 一些的,错的更多,实际体现为解决问题的方法上的欠缺。等电子 体的判断一般可采取以下几种方法:
一、同族元素互换法
即将既定粒子中的某元素换成它的同族元素。如:
1. CCl4的等电子体确定
将C换成与它同族的IVA族元素有SiCl4、GeCl4等;将Cl换与它同族的ⅦA族元素有CF4、CBr4、CI4、CFCl3……同时将C和 Cl换成其同族元素可有SiF4、SiFCl3……
2. CO2的等电子体确定
将O换成与之同族的ⅥA族元素S有COS、CS2,注意不能将 C原子换成与之同族的Si原子,因为SiO2为原子晶体,晶体中无 单个SiO2分子。同理,不能将BeCl2的等电子体确定为MgCl2或BeF2, MgCl2和BeF2为离子晶体,晶体中无单个MgCl2和BeF2分子。
3.SO42-的等电子体确定
将一个O原子换成与之同族的S原子得S2O32-。
4.对于原子晶体类也可作类似推导
含相同原子数的金刚石(Cn)与晶体硅(Sin)互为等电子体。
二、价电子迁移法
即将原粒子中的某元素原子的价电子逐一转移给组成中的另一种元素的原子,相应原子的质子数也随之减少或增加,变换为具有相应质子数的元素。
1.CO2的等电子体确定
除了上述结果以外,还可以采用价电子迁移法:C、O原子的价电子数分别为4、6,而N原子价电子数为5,一个O原子拿一个电子给C原子,在电性不变的条件下,价电子数同时变为5,质子数同时变为7,则可换为两个N原子得N2O;如果将一个C原子的两个价电子转移给两个O原子,则一个C原子和两个Cl原子分别转换成为一个Be原子和两个Cl原子,就可以得到CO2的另一 种等电子体BeCl2
同样可以判断:金刚石(C2)与晶体硅(Si2)的等电子体还可以为金刚砂(SiC)n、CaAs、AlP等;石墨(C2n)的等电子体可为白石墨 (BN)n;无机苯B3N3H6的等电子体可为有机苯C6H6。
2.离子之间的等电子体的确定
与N3-的等电子体查找方法相同,可将两个N原子换为一个C 原子和一个O原子可得CNO-。
三、电子一电荷互换法
即将既定粒子中的某原子的价电子转化为粒子所带的电荷。这 种方法可实现分子与离子等电子体的互判。如,CN-的等电子体查找可用N原子一个电子换作一个负电荷,则N原子换为C原子,离子带两个负电荷,其等电子体即为C22-;反之,将CN-的电荷转化为一 个电子,该电子给C原子,即得N2,若给N原子即得CO。同样可判断HNO3的等电子体为HCO3-,ICl4-的等电子体为XeCl4。
在具体问题分析时,通常几种方法同时应用,才能快速准确 地做出判断和回答问题。现以几例说明(文中所用题目为高考或 各地质量检测题,原题中与本文无关的内容均略去)。
例题1.(2013江苏21(12分)【选做题】A.[物质结构与性质]
元素X位于第四周期,其基态原子的内层轨道全部排满电 子,且最外层电子数为2。元素Y基态原子的3p轨道上有4个电 子。元素Z的原子最外层电子数是其内层的3倍。
(4)Y与Z可形成YZ42-
②写出一种与YZ42-互为等电子体的分子的化学式__________ 。
分析:由题意知,Y为S,Z为O,YZ42-为SO42-。至于SO42-的等电 子体的确定可采用上述电子一电荷互换法,即将2个负电荷去掉 少了 2个价电子,将4个O原子换成4个Cl原子多了 4个价电子, 再将那1个S原子换成1个C原子少2个价电子,这样成为CCl4 就保持了原子总数和价电子总数不变,CCl4就是SO42-的等电子体; 再用上述的同族元素互换法将C换成Si得SiCl4,将Cl换成F成CF4或换成Br成CBr4,因此,SiCl4、CF4、CBr4也是SO42-的等电子体。
答案:CCl4、SiCl4、CF4、CBr4 等任填一种。
例题2.(2009年江苏化学)生物质能是一种洁 净、可再生的能源。生物质气(主要成分为CO、CO2、H2等)与H2混 合,催化合成甲醇是生物质能利用的方法之一。
(2)根据等电子原理,写出CO分子结构式_______________ 。
分析:根据等电子原理,等电子体具有相同的结构特征,要写 CO分子的结构式,首先要找到CO的等电子体中已知结构式的物 质,按照上述价电子迁移法,将C原子换成N原子多1个价电子, O原子换成N原子少1个价电子,能保持原子总数和价电子总数 不变,CO的等电子体可为N2,而N2分子的结构式是我们熟悉的, 仿照队的结构式写出CO的结构式为C O
O
答案:C O
O
例题3.(2008年江苏化学.21A)(12分)已知A、B、C、D、E都 是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E。其中 A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体, D的二价阳离子与C的阴离子具有相同的电子层结构。AC2为非 极性分子。B、C的氢化物的沸点比它们同族相邻周期元素氢化物 的沸点高。E的原子序数为24,ECl3能与B、C的氢化物形成六配 位的配合物,且两种配体的物质的量之比为2:1,三个氯离子位于 外界。请根据以上情况,回答下列问题(答题时,A、B、C、D、E用所对应的元素符号表示)
(3) 写出化合物AC2的电子式
组成的化合物与AC2互为等电子体,其化学式为____________ 。
分析:据推断A为C,B为N,C为O,AC2是CO2,其等电子体 的推断见上述“二、价电子迁移法1.CO2的等电子体确定”。
答案::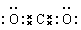 N2O
N2O

- 全部评论(0)
