苯酚性质疑难解析
时间:2016-05-13 09:54 来源:深圳清华实验学校 作者:何永成 点击:次 所属专题: 苯酚
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
作者:深圳清华实验学校 刘全明
苯酚是无色透明的晶体,熔点43℃,沸点182℃,常 温下在水中溶解度不大,过量苯酚放水中很快熔化为液 态,形成乳浊液,当加热到65℃以上时,苯酚与水能以任意比例混溶……
问题1.苯酚的熔点为43℃,为何常温下苯酚在水中能熔为液态?
问题2.常温下,苯酚在水中的溶解度不大,65℃时 却能与水以任意比例混溶?
问题3.水溶液中的苯酚能否结晶析出?在什么情 况下能结晶析出?
近来,本人做了大量实验,并查阅有关资料,进行综 合分析、推理,现将结论提供给同行参考。
为了说明问题,我作了下列有关实验。
实验1、将10 g 苯酚放入盛有5 mL 水的大试管中, 苯酚晶体很快培化成液态,振荡后为不透明乳浊液。静 置片刻,溶液分为上下两层,上层带油状,无色透明,下 层为水溶液层,无色透明。将该试管加热到65℃时,乳浊液转化为无色透明溶液,恒温下继续向试管中加入苯 酚晶体,晶体完全溶解,毫无限度。
实验2、将2 g 苯酚晶体放入表面皿,再置于潮湿的 空气中,苯酚晶体因吸潮而漫漫熔成液态;在表面皿中 放人5 g 苯酚,滴加2滴水,苯酚晶体很快熔成单一的无色透明的液体。
实验3、向盛有2 mL CCl4的试管中加人苯酚晶体, 当加到3.6 g 时苯酚不再溶解,继续加入,苯酚晶体不溶 解也不熔化。
实验4、用滴管吸取实验1试管中的上层液体少许 放入表面皿中,在常温下放置,不凝结成晶体,放入干燥 器中经浓硫酸干燥,常温下全部凝结成无色透明晶体。
实验5、将实验1中的溶液,通过分液后将上层与下 层溶液分别装入两支小试管,并将该两支试管放人用冰 与食盐制成的冷冻剂中降温。当温度降至14℃时,上层 液体出现浑浊,随着温度的降低,浑浊加深,但无晶体析 出,温度降到-2℃左右,乳浊液全部凝结成无色透明的 混合物晶体。下层苯酚的水溶液随着温度的下降,浑浊现象不明显(可能是因溶解的苯酚太少),当温度降至 -2℃左右时,同样凝结成无色透明的混合物晶体。
上述实验可以归纳出下列结论:
实验1、实验2证实了 :( 1)常温下苯酚在水中的溶 解度不大,65℃以上时,苯酚与水能混溶;(2)只要有少 量的水,苯酚晶体在常温下很快被熔化。
实验3说明苯酚易溶于非极性试剂,但非极性试剂不能促成苯酚晶体培化。
实验4说明了苯酣乳浊液静置分层,上层液不是溶化的纯苯酚,而是水的苯酚溶液,也可以说是苯酚的过 饱和溶液,下层为苯酚的饱和溶液。根据实验5可知, 无论是上层或者下层溶液,随着温度的下降,都出现浑 浊,形成乳浊液。当温度降至-2℃左右时,均凝结成无 色透明的混合物晶体。所以,-2℃应该是该低共熔混合物的低共熔点。浊液的熔点比组成该溶液的苯酚和 水的熔点低,这合乎一般混合物的熔点特点。实验4与 实验5还证明了苯酚的溶解度随着温度的降低而降低, 但析出的不是纯苯酚,而是苯酚的过饱和溶液。因此。 降温,不可能从水溶液中析出苯酚晶体。要析出苯酚晶 体,只有将苯酣溶液中的水吸收后,常温下可自然结晶。
苯酚的熔点为43℃,为什么常温下能在水中熔化成 液态?
因为苯酸分子是极性分子,其质量(相对分子质量 84)较大,范德华力较乙醇、苯、水都强,又由于苯酚分子 间还能形成氢键,所以苯酚分子间作用力增大,常温下 形成晶体。但熔点只比常温高出十多度,并不算很高。 这样接近常温熔点的晶体。很容易被熔化成液态。水 分子是一个极性较强的分子,体积小,还能跟苯酚分子 形成较强的氢键。当苯酚晶体与水接触时,在水分子的 作用下,苯酚分子间作用力大大地被削弱,因而常温下 被熔化成液态。实验3中的CCl4等非极性试剂只能溶 解苯酸不能使苯酸溶化的事实,进一步说明了上述分析 的正确性。
常温下苯酚在水中被溶化,不能用一般的相平衡和 相转移的理论解释。苯酚晶体与水组成的体系,水的饱 和蒸气压大于苯酚的饱和蒸气压,与相转移相矛盾。但 是这里又说明了一个问题,这样,水会被转移溶于苯酚, 形成水的苯粉饱和溶液。
为什么苯酚在常温下溶解度不大,65℃以上时能与 水以任意比混溶?
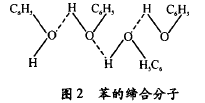
苯酚分子由苯基(C6H5-)和羟基(-OH)组成,羟基有亲水性,应能溶于水。苯酚分子是一个极性较强的分子。根据相似相溶原理,苯酚可溶于水。尤其苯酚分 子能与水分子之间形成氢键,所以,苯酚应属于易溶于水的物质。但是在常温下,苯酸在水中的溶解度不大,其原因是组成苯酚分子的苯基有疏水性,苯基的这种性质, 大大地削弱了苯酚溶于水的作用。并且液态苯酚分子间由氢键的相互作用而发生缔合现象成为缔合分子(见图 2),温度越低,缔合程度越大,这种缔合也能大大地削弱 苯酚的溶解,因此常温下苯酚在水中溶解度不大。
为什么苯酚在65℃以上时能与水以任意比例互溶?
现从分子空间构型和相图转移两方面解释。
(1)水分子中由于氧原子按sp3杂化与氢原子形成 共价键,因而水分子是一个极性分子,空间构型为V型, 键角为105°。水分子间由于氢键作用可发生缔合,成为缔合分子。
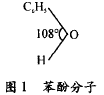
苯酚分子和水分子极为相似,同样属于极性分子,空间构型仍为V型,键角约为108°(图1)。苯酸分子间由于氢键作用发生缔合,成为缔合分子。
当温度升髙至65℃时,苯酚分子间的缔合减弱,又 由于水分子与苯酚分子结构相似,此时,水分子与苯酚 分子相互间也发生缔合作用,完全可以任意相互参差结 合(见图3)。
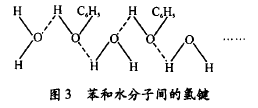
这就表现出苯酚和水不但可以相溶,而且可以任意比例相互混溶。
(2)从相图转移角度分 析,更能直观表明苯酚与水在 65℃以上时能以任意比混溶 的道理。
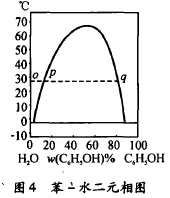
在恒温下把苯酚逐 步加人水中(见图4),物系点即由相图中o点往右移,开始时少量的苯酚完全溶于水中,故出现单一液相。当物系点到达p点,苯酚在水中溶解已达到饱和,继续加入苯酚,苯酚不再溶解,于是苯酚本身 形成另一层液相。由于酚层与水溶液接触,酚层也要溶解水,于是通过自动调节作用,水溶液层就有一部分水 转入酚层,直到酚层中溶解的水达到饱和。水溶液的相点仍为p点,酚层的相点以q点表示。这样,在一定温度 下,就得到两层液体各自达到相互溶解饱和时的一对相点。随着温度上升,各自的饱和溶解度都要增加,故相点的连线向上移,并相互靠拢,表明达成平衡的两相组成接近。到65℃时,两组成完全相、同,相的界限消失了, 只剩下单一液相,此时酚与水完全互溶。因此只要温度 升至65℃以上时,酚与水就能以任意比混溶。相反,随着温度的下降,各自饱和溶解度都要减少,故两相点连线向下移,两相点距离逐渐拉大,表明两相液体组成逐渐纯化。温度降至-2℃时,两相液体同时凝结成晶体, 说明苯酚水溶液降温不可能析出纯苯酚晶体。

- 全部评论(0)
(121986143) 评论 苯酚性质疑难解析:说的很好,从结构的角度解答了我的疑惑
