电化学中的几种计算类型问题
时间:2016-06-04 16:55 来源:未知 作者:李留记 点击:次 所属专题: 电化学计算
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
电化学知识是中学无机化学理论中不可缺少的组成 部分,电化学中的计算类问题主要包括:两极产物的定量 计算、溶液pH的计算、相对原子质量和阿伏加德罗常数 测定的计算、元素化合价或物质化学式的确定等.在解决 上述问题时,其思路是在准确选用恰当的计算方法的基 础上,还应明确被电解者、电解池的连接及装置的类别.
下面结合具体的实例来谈谈上述问题的解答方法.
1.极产物的定量计算——总反应式法
例1 25℃时,将两个Pt电极插人一定量的硫酸钠 饱和溶液中,进行电解,通电一段时间后,在阳极逸出 amol气体,同时有Wg Na2SO4 • 10H2O晶体析出,若温度不变,则此时剩余的硫酸钠溶液的质量分数是多少?
分析首先要明确电解对象,该问题中电解硫酸钠溶液实质上就是电解水.根据总反应式2H2O  2H2 + O2知:阳极逸出a mol气体即为a mol O2,同时电解了2a mol的水.因为溶液是饱和溶液,所以从饱和溶液中析 出晶体后剩余溶液也是饱和的,即2a mol的水与w g Na2SO4 • 10H2O晶体组成的溶液也是饱和的且其质量分数与析出晶体后剩余溶液的质量分数相等。
2H2 + O2知:阳极逸出a mol气体即为a mol O2,同时电解了2a mol的水.因为溶液是饱和溶液,所以从饱和溶液中析 出晶体后剩余溶液也是饱和的,即2a mol的水与w g Na2SO4 • 10H2O晶体组成的溶液也是饱和的且其质量分数与析出晶体后剩余溶液的质量分数相等。
即析出晶体后剩余溶液的质量分数为:(W ×142/ 322) ÷(W + 36a) ×100% 。
2. 溶液pH的计算——电子守恒法与关系式法
例2用Pt电极电解串联电路中分装在甲、乙两个 烧杯中的200mL 0. 3mol/L的NaCl溶液和300mL 0. 2mol/L AgNO3溶液,当产生0. 56L(标准状况)Cl2时停 止电解,取出电极,将两杯溶液混合,则混合溶液的pH为 多少?(假设混合液的总体积为500mL)
分析电解NaCl溶液时,被电解的是氯化钠和水.所以
阳极:2Cl- -2e-=Cl2 阴极:2H+ +2e-=H2
当产生0. 56L(标况)Cl2时,根据总电解反应式知:
2NaCl + 2H2O  2NaOH + Cl2 + H2 转移电子
2NaOH + Cl2 + H2 转移电子
2mol 22.4L 2mol
0.05mol 0. 56L 0. 05mol
根据串联电路中通过电极上的电子守恒得出电解 AgNO3溶液时:
阳极 4OH- -4e-=2H2O + O2
阴极 Ag+ + e-=Ag
总的电解反应式为:
4AgNO3 +2H2O 4 Ag + O2 +4HNO3 转移电子
4 Ag + O2 +4HNO3 转移电子
4 mol 4 mol 0. 05mol 0. 05mol
由此可见,生成了等物质的量的NaOH和HNO3,故 混合液应为中性.
3. 确定物质的化学式(或相对原子质量的测定)—— 电子守恒法
例3向8g 二价金属氧化物固体中加入稀硫酸使其恰好完全溶解,已知所消耗稀硫酸为l00mL,在所得溶液中插入惰性电极进行电解,通电一段时间后,在一个电极 上收集到224mL标准状况下的氧气,在另一电极上析出 该金属1.28g。通过计算确定该金属氧化物的化学式。
分析设该金属氧化物的化学式为RO,该金属的相对原子质量为M。
根据题意有:RO+H2SO4(稀)=R2SO4 +H2O
阳极:4OH- -4e-=2H2O + O2
4 mol 0. 04 mol
阴极:R2++2e-=R
2 mol M
0. 04mol 0.02M
即0.02M = 1.28
M = 64所以该金属为铜,其氧化物的化学式为CuO。
4. 阿伏加德罗常数的测定—— 电子数守恒和关系式法
例4右图所示装置可用于测量阿伏加德罗常数。
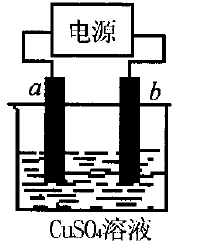
现用纯铜片做电极,插人硫酸铜的稀溶液中.若当以 I= 0.21A的电流电解60min后,测得铜片a的质量增加了 0. 25g,列式计算实验测得的阿伏加 德罗常数NA(已知电子电量e = 1.60×l0-19C)
分析:根据题意铜片a的质量增加可知,a极与电源 的负极相连,即a极为阴极,且发生Cu2++ 2e- =Cu。
则
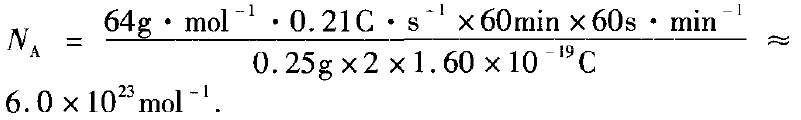
5. 注意电解池的连接方式——串联或并联
例5甲、乙、丙三个电解池按图所示连接(其中电极 的大小、形状、间距均相同),乙、丙中溶液的浓度和体积相同。当通电一段时间后,如若甲中铜电极的质量增加 0.128g时,乙中电极上银的质量应增加多少?
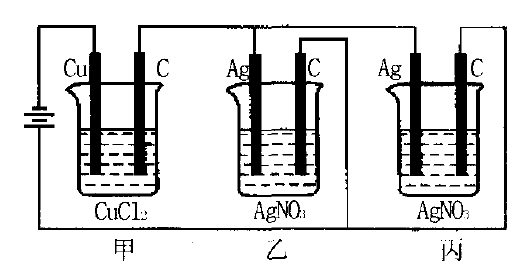
分析多个电解池串联时,相同时间内通过各个电 解池的电量相等;多个电解池并联时,加在每个电解池上的电压相同,且相同时间内通过各个电解池的电量与其电阻成反比,不一定相同。
从图可知:乙、丙并联后再与甲串联;乙、丙两电解池完全相同。
故有I丙=I乙 =l/2I甲
因为通过甲池的电子的物质 的量为:0. 128 ÷ 64 × 2 = 0.004(mol),所以通过乙、丙池的电子的物质的量为甲池的一半,即0.002mol。
故乙中电极上银应增加的质量为:0. 002 × 108 = 0.216(g).
6. 注意装置类型的判断 —— 电解池或原电池
例6如图所示3与B试管中电极为多孔的惰性电 极,C和D为夹在湿的滤纸上的铂夹,a、b为电源电极.切 断K1,闭合K2、K3,通电一段时间后,则理由是 。
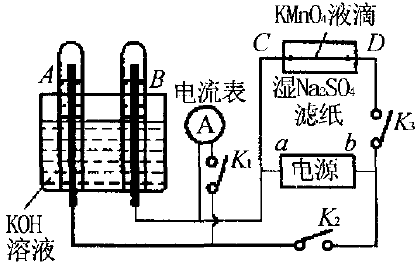
(1)在湿的滤纸中心的液滴处,戏擦到的现象是
(2)若电解一段时间后,切断K2、K3,闭合K1,则电流表的指针会不会移动?为什么?
分析:要搞清楚原电池和电解池的本质区别,不要被组成类似所迷惑。
(1) 切 断K1,闭合K2、K3,B管中产生气体多,应为H2,因此,a为负极,b为正极.故可观察到的现象是紫色向D 方向移动,理由是D为电解池的阳极,MnO4-向其移动。
(2) 切 断K1,闭合K2、K3,B中H2、A中O2与KOH溶液形成燃料电池,因此电流表会移动。
总之,解决电化学中的相关计算问题的切人点应该 为:把计算问题看做是氧化还原反应理论知识的拓展与延伸,并能灵活运用上述相关解决问题的方法,许多问题 都会变得“柳暗花明”的画面。

- 全部评论(0)
