热点物质:氯化亚砜介绍以及高考解题应用
时间:2020-03-05 19:16 来源:未知 作者:化学自习室 点击: 次 所属专题: 氯化亚砜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
氯化亚砜,淡黄色至红色、发烟液体,有强烈刺激气味。可混溶于苯、氯仿、四氯化碳等有机溶剂。遇水水解,加热分解。主要用于制造酰基氯化物,还用于农药、医药、染料等的生产。
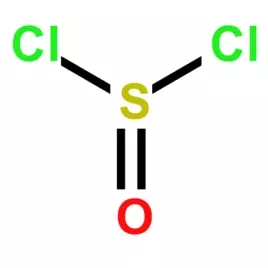
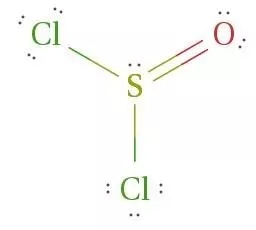
一、空间构型与杂化方式
方法一:(6+0+2)/2=4,是sp3杂化,中心原子硫和两个氯原子呈共价键,硫自身含有两对孤对电子(其中一对与氧原子配位),因此中心原子S为sp3杂化,呈三角锥形。
方法二:根据价电子对互斥理论确定微粒的空间构型,SOCl2中S原子成2个S-Cl键,1个S=O,价层电子对个数=σ键个数+孤电子对个数=3+(6-1—1-2)/2=4,杂化轨道数是4,故S原子采取sp3杂化,含一对孤电子,分子形状为三角锥形。
二、高考题回顾
例1、(09年海南化学·15)Li—SOCl2电池可用于心脏起搏器。该电池的电极材料分别为锂和碳,电解液是LiAlCl4—SOCl2。电池的总反应可表示为:4Li+2SOCl2=4LiCl+S +SO2。
请回答下列问题:
(1)电池的负极材料为 ,发生的电极反应为 ;
(2)电池正极发生的电极反应为 ;
(3)SOCl2易挥发,实验室中常用NaOH溶液吸收SOCl2,有Na2SO3和NaCl生成。如果把少量水滴到SOCl2中,实验现象是 ,反应的化学方程式为 ;
(4)组装该电池必须在无水、无氧的条件下进行,原因是 。
【答案】
(1)锂 Li-2e-=Li+
(2)2SOCl2+4e-=4Cl-+S+SO2
(3)出现白雾,有刺激性气体生成 SOCl2+H2O=SO2↑+2HCl↑
(4)锂是活泼金属,易与H2O、O2反应;SOCl2也可与水反应
三、模拟题回顾
例2、氯化亚砜(SOCl2)为无色或浅黄色发烟液体,易挥发,遇水分解,其制取过程的相关反应如下:
S(s)+Cl2(g)==SCl2 (l) (Ⅰ)
SCl2(l)+ SO2 (l)=SOCl2(l)+ SO2 (g) (Ⅱ)
已知二氯化硫(SCl2)熔点-78°C,沸点59°C,下图是实验室由氯气与硫合成二氯化硫的装置。
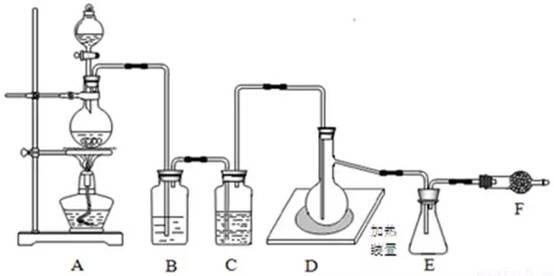
(1)仪器组装完成后,首先进行的一步操作是 ;反应前要先排尽系统中空气,此做法目的是 。
(2)装置B盛放的药品是 ,装置D中玻璃仪器的名称是 ,向其中放入一定量的硫粉,加热使之融化,轻轻摇动使硫附着在容器的内壁,形成一薄层膜,这样做的优点是 。
(3)实验时,为防止E中液体挥发,可采取的措施是______。装置F(盛放碱石灰)有两个作用:一是吸收多余的氯气,另一个是 。
(4)工业上以硫黄、液氯和液体三氧化硫为原料,能生产高纯度(99%以上)氯化亚砜,为使三种原料恰好完全反应,三者的物质的量比为______;氯化亚砜遇水易分解,请设计简单的实验来验证氯化亚砜与水完全反应的产物,简要说明实验操作、现象和结论______。
已知:SOCl2+4NaOH=Na2SO3+2NaCl+2H2O
供选择的试剂:稀盐酸、稀硝酸、氯化钡溶液、硝酸银溶液、品红溶液
【答案】(1)检查装置气密性 防止加热硫粉时,空气中的氧气与硫粉反应
(2)饱和食盐水;蒸馏烧瓶 增大反应物接触面积(使反应更加充分)
(3)将锥形瓶放入冰水中冷却(冷水浴或冰水浴);防止空气中水蒸气进入
(4)1:1:1;分别取两份水解后的溶液于试管中,向其中一支试管中加入品红溶液,品红褪色,说明有二氧化硫生成;向另一支试管中加入硝酸银溶液,生成白色沉淀,说明有HCl生成。(3分,操作1分,每检出1种水解产物得1分。以上仅为参考答案,只要设计合理均给分。)
例3、二氯亚砜(SOCl2)是一种无色易挥发液体,与水剧烈水解生成两种气体,常用作脱水剂,其熔点-105℃,沸点79℃,140℃以上时易分解
(1)用硫黄(用S表示)、液氯和三氧化硫为原料在一定条件合成氯化亚砜,原子利用率达100%,则三者的物质的量比为 .写出SOCl2吸收水蒸气的化学方程式
(2)甲同学设计如图装置用ZnCl2•xH2O晶体制取无水ZnCl2,回收剩余的SOCl2并验证生成物中含有SO2(夹持及加热装置略)
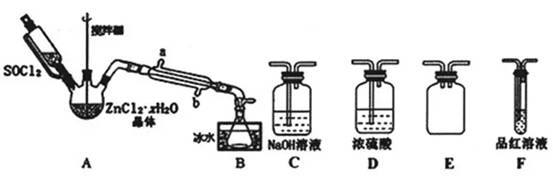
①装置的连接顺序为A→B→___→___→___→___.
②冷凝管的进水口是___.(填“a”或“b”)
③实验结束后,为检测ZnCl2•xH2O晶体是否完全脱水,称取蒸干后的固体ag溶于水,加入足量稀硝酸和硝酸银溶液,过滤,洗涤,干燥,称得固体为bg.若a/b=___(保留一位小数),即可证明ZnCl2•xH2O晶体已完全脱水.
④乙同学认为直接将ZnCl2•xH2O晶体置于坩埚中加热灼烧即可得到无水ZnCl2,但大家说此方法不可行,请用化学方程式解释原因___.
(3)丙同学认为SOC12还可用作由FeCl3•6H2O制取无水FeCl3的脱水剂,但丁同学认为该实验会发生氧化还原反应.戊同学设计了如下实验方案判断丁同学的观点:
取少量FeCl3•6H2O于试管中,加入过量SOCl2,振荡使两种物质充分反应;再往试管中加水溶解,滴加KSCN溶液,若___,则证明脱水过程中发生了氧化还原反应.按照戊同学的思路方法,还可以选择证明___或___(填离子符号)是否存在证明该过程是否发生了氧化还原反应.
【答案】
(1)2:3:1;SOCl2+H2O=SO2↑+2HCl↑;
(2)①A中SOCl2吸收结晶水得到SO2与HCl,用冰水冷却收集SOCl2,浓硫酸吸收水蒸气,防止溶液中水蒸气加入B中,用品红溶液检验二氧化硫,用氢氧化钠溶液吸收尾气中二氧化硫与HCl,防止污染环境,E装置防止倒吸,装置的连接顺序为A→B→D→E→F→C,故答案为:D;E;F;C;
②逆流冷却效果好,应从b口进水,
③2.1;
④ZnCl2•xH2O==2HCl+ZnO+(x-1)H2O;
(3)若发生氧化还原反应,则Fe3+会被还原为Fe2+,而SOCl2水解得到SO2会被氧化为H2SO4,可以检验硫酸根、亚铁离子或铁离子判断,检验铁离子,滴加KSCN溶液,若没有明显现象,则证明脱水过程中发生了氧化还原反应,故答案为:没有明显现象;Fe2+、SO42-。

- 全部评论(0)
