OH-与含氧酸根离子放电顺序浅谈
时间:2019-09-01 11:43 来源:未知 作者:陈永忠 点击:次 所属专题: 放电顺序
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
在高三复习资料中遇到一道关电解的练习题:写出用惰性电极电解锰酸钾的碱性溶液制取高锰酸钾的阳极反应式.
质疑:锰酸钾的碱性溶液中存在的离子有K+、H+、MnO4-、OH-,用惰性电极电解时,阴极上阳离子放电,且H+放电顺序在K+之前,故阴极反应式为2H++2e-=H2或2H2O+2e-=H2+2OH-;阳极上阴离子放电,按教学参考放电顺序OH-大于含氧酸根离子,故阳极反应式为4OH--4e-=O2+2H2O,但是给出答案为MnO42--e-=MnO4-
不同的答案引发了学生的质疑,那么该题如何分析作答呢?阴离子的放电顺序一定是OH-大于含氧酸根离子吗?
1、实验探究
1)实验用品
学生电源,U形管,石墨电极,导线,铁架台,铁夹,量筒(100mL),烧杯,锰酸钾,0.5、1.0、2mol·L-1
的3种氢氧化钾溶液.
2)实验原理
a)装置如右图(加持装置未画出).
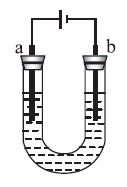
b)若阳极上产生无色气泡,则阳极反应式为4OH--4e-=O2+2H2O,若阳极区溶液变紫红色,则阳极反应式为MnO42--e-=MnO4-
3)实验操作
第1步:配制锰酸钾碱性溶液.在0.5、1.0、2.0mol·L-1的各100mLKOH溶液中分别加入0.2gK2MnO4,振荡即得绿色锰酸钾的3种碱性溶液.
第2步:电解锰酸钾碱性溶液.按装置图组装好仪器,在Ⅰ、Ⅱ、Ⅲ3支U形管中分别注入第1步配制的3种锰酸钾碱性溶液,接通直流电源电解,记录现象.
4)实验现象
Ⅰ中阴极出现少量气泡,溶液由绿色变无色;阳极无气泡,阳极溶液由绿色变红,最后变为紫红色.
Ⅱ中阴极出现较多量气泡,溶液由绿色变无色;阳极有气泡,溶液由绿色变红,最后变为紫红色.
Ⅲ中阴极出现大量气泡,溶液由绿色变无色;阳极出现个别气泡,溶液由绿色变红,最后变为深红色.
5)实验结论
实验表明:用惰性电极电解锰酸钾碱性溶液时,阳极反应既有MnO42--e-=MnO4-,又有4OH--4e-=O2+2H2O.所以U形管 Ⅰ、Ⅱ中阳极上电极反应以MnO42--e-=MnO4-为先;U形管Ⅲ中阳极上电极反应以4OH--4e-=O2+2H2O为先,且O2+4MnO42-+2H2O=4MnO4-+4OH-,总反应为MnO42--e-=MnO4-.
2 理论分析
阴离子放电顺序实际是阴离子失电子的难易顺序(即阴离子还原性强弱的先后顺序),可根据能斯特方程来判断.能斯特方程一般通式为
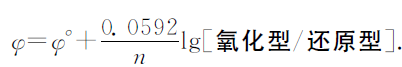
碱性溶液中:MnO4-+e-=MnO42-,φ°=0.558V,其能斯特方程表达式为
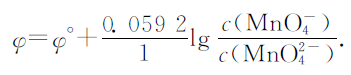
在上述3种锰酸钾碱性溶液中c(MnO42-)=0.1mol·L-1,c(MnO4-)=10-5 mol·L-1,φ=0.3212.碱性溶液中:O2+2H2O+4e-=4OH-,φ°=0.401V,其能斯特方程表达式为
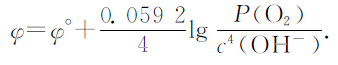
在上述3种锰酸钾碱性溶液中,取P(O2)=1,
C(OH-)=0.5mol·L-1时,φ=0.5786;
C(OH-)=1.0mol·L-1时,φ=0.4010;
C(OH-)=2.0mol·L-1时,φ=0.2234.
由上述分析可知c(OH-)=0.5mol·L-1时,MnO42-的还原性强于OH-的c(OH-)=1.0mol·L-1时,MnO42-的还原性强于OH-的c(OH-)=2.0mol·L-1时,OH-的还原性强于MnO42-的.所以U形管 Ⅰ、Ⅱ中阳极上电极反应以MnO42--e-=MnO4-为先;U形管 Ⅲ中阳极上电极反应以4OH--4e-=O2+2H2O为先,O2+4MnO42-+2H2O=4MnO4-+4OH-,总反应为MnO42--e-=MnO4-.
阴离子的放电顺序是受多种因素影响的,OH-与含氧酸根离子的放电顺序要看它们的还原性强弱,像SO42-、NO3-、CO32-等无还原性的含氧酸根离子放电顺序应在OH-之后,而像MnO42-、NO2-、S2O32-、SO32-等还原性强的含氧酸根离子放电顺序应在OH-之前,另外还需考虑OH-浓度的大小.

- 全部评论(0)
