有关离子交换膜问题
时间:2020-03-09 11:47 来源:未知 作者:化学自习室 点击:次 所属专题: 离子交换膜
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一.离子定向移动目的
1.去某极参加反应
2.平衡某侧电荷,使溶液呈电中性
二.离子交换膜(阳离子、阴离子、质子)的作用
1.隔离某些物质,防止阴极与阳极产物之间或产物与电解质溶液发生反应
2.用于某些物质的制备:通过离子定向移动使得阴极区或阳极区得到所制备的物质
3.物质分离、提纯
三.示例
1.两室电解池,
如:氯碱工业,如图

阳极室中电极反应:2Cl--2e-===Cl2↑;
阴极室中的电极反应:2H2O+2e-===H2↑+2OH-。
阴极区H+放电,破坏了水的电离平衡,使OH-浓度增大,阳极区Cl-放电,使溶液中的c(Cl-)减小,为保持电荷守恒,阳极室中的Na+通过阳离子交换膜与阴极室中生成的OH-结合,得到浓的NaOH溶液。利用这种方法制备物质,纯度较高,基本没有杂质。
阳离子交换膜的作用:只允许Na+通过,而阻止阴离子(Cl-)和气体(Cl2)通过。防止两极产生的H2和Cl2混合爆炸,又避免了Cl2和阴极产生的NaOH反应生成NaClO而影响烧碱的质量。
2.三室电解池,
如:利用三室电解装置制备NH4NO3,如图

阴极的NO被还原为NH4+,NO+5e-+6H+===NH4++H2O,NH4 +通过阳离子交换膜进入中间室;
阳极的NO被氧化为NO3-,NO-3e-+2H2O===NO3-+4H+,NO3-通过阴离子交换膜进入中间室。
总反应:8NO+7H2O ==3NH4NO3+2HNO3,为使电解产物全部转化为NH4NO3,补充适量NH3可以使电解产生的HNO3转化为NH4NO3。
3.多室电解池,
如:利用“四室电渗析法”制备H3PO2(次磷酸),如图

电解稀硫酸的阳极反应:2H2O-4e-===O2↑+4H+,产生的H+通过阳离子交换膜进入产品室,原料室中的H2PO2-穿过阴离子交换膜进入产品室,与H+结合生成弱电解质H3PO2;
电解NaOH稀溶液的阴极反应:4H2O+4e-===2H2↑+4OH-,原料室中的Na+通过阳离子交换膜进入阴极室。
四.例题分析
1.(2018·全国卷Ⅰ节选)制备Na2S2O5可采用三室膜电解技术,装置如图所示,其中SO2碱吸收液中含有NaHSO3和Na2SO3。阳极的电极反应式为 。电解后, 室的NaHSO3浓度增加。将该室溶液进行结晶脱水,可得到Na2S2O5。

[解析] (2)根据题中的图示,左侧为电解池的阳极,右侧为电解池的阴极,离子交换膜均为阳离子交换膜,只允许阳离子通过,阳极的电解质溶液为硫酸,所以阳极的电极反应式为2H2O-4e-===4H++O2↑,则阳极的氢离子会透过阳离子交换膜进入a室,与a室中的SO2碱吸收液中含有的Na2SO3发生反应生成NaHSO3,所以a室中的NaHSO3浓度增加。
[答案] (2)2H2O-4e-===4H++O2↑ a
2.氢碘酸(HI)可用“四室电渗析法”制备,其工作原理如图所示(阳膜和阴膜分别只允许阳离子、阴离子通过)。下列叙述错误的是( )

A.通电后,阴极室溶液的pH增大
B.阳极电极反应式是2H2O-4e-===4H++O2↑
C.得到1 mol 产品HI,阳极室溶液质量减少8 g
D.通电过程中,NaI的浓度逐渐减小
解析:选C 通电后,阴极电极反应式为2H2O+2e-===2OH-+H2↑,则溶液的pH增大,故a正确;阳极上发生氧化反应,电极反应式为2H2O-4e-===4H++O2↑,故b正确;根据阳极电极反应式可知得到1 mol 产品HI,则转移1 mol 电子,阳极室溶液质量减少9 g,故C错误;通电过程中,原料室中的Na+移向阴极室,I-移向产品室,所以NaI的浓度逐渐减小,故D正确。
3.【2012年北京卷25题节选】直接排放含SO2的烟气会形成酸雨,危害环境。利用钠碱循环法可脱除烟气中的SO2。
(2)在钠碱循环法中Na2SO3,溶液作为吸收液,可由NaOH溶液吸收SO2制得,该反应的离子方程式是。
(3)吸收液吸收SO2的过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:

(4)当吸收液的pH降至约为6时,送至电解槽再生。再生示意图如图所示:
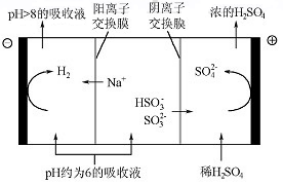
①HSO3-在阳极放电的电极反应式是HSO3--2e-+H2O=SO42-+3H+。
②当阴极室中溶液pH升至8以上时,吸收液再生并循环利用。简述再生原理:H+在阴极得电子生成H2,溶液中c(H+)降低,促使HSO3-电离生成SO32-,且Na+进入阴极室,吸收液得以再生。

- 全部评论(0)
