铝及其化合物性质知识点总结
时间:2023-08-13 19:21 来源:未知 作者:化学自习室 点击:次 所属专题: 铝及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
一、铝
(一)铝的结构和存在
1、结构
(1)原子结构示意图:

(2)在周期表中的位置:第三周期ⅢA族
2、存在
(1)含量:地壳中含量最丰富的金属,仅次于氧、硅。
(2)形态:自然界中的铝全部以化合态存在
(二)铝的物理性质
1、色质态:
银白色有金属光泽的质软的固体
2、熔沸点:
熔点660.4℃,沸点2467℃
3、三性:
延展性、导热性和导电性良好
4、密度:
2.7g/cm3,是一种轻金属
(三)铝的化学性质

1、Al与O2的反应
| 实验现象 | 铝箔熔化,失去光泽,熔化的铝不滴落 |
实验结论 | 常温下,铝与空气中的氧气反应,生成一薄层致密的氧化膜 | |
实验原因 | 铝表面生成的氧化膜(Al2O3)的熔点高于铝的熔点,包在铝的外面,所以熔化的液态铝不滴落 | |
化学方程式 | 常温时: 4Al+3O2===2Al2O3 加热时:
|
注意:
①常温下铝易与空气中的氧气反应,表面生成致密而坚硬的氧化铝薄膜,能阻止氧气等与铝进一步反应,因此铝具有很强的抗腐蚀性
②铝的化学性质活泼,但在日常生活中广泛使用的铝制品由于形成一层致密的氧化膜,保护铝不再被氧化,通常具有较好的抗腐蚀性能
③空气中久置的铝箔和用砂纸打磨的铝箔在酒精灯火焰上加热,铝箔
2、Al与其它非金属的反应
①与Cl2反应:
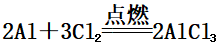
②与S反应:

3、Al与酸的反应
(1)与非氧化性酸(如:稀盐酸、稀硫酸)的反应——铝与盐酸反应
铝与盐酸反应 | |
实验操作 |
|
实验现象 | 铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声 |
化学方程式 | 2Al+6HCl===2AlCl3+3H2↑ |
离子方程式 | Al+6H+===2Al3++3H2↑ |
(2)与氧化性酸(如:硝酸、浓硫酸)的反应
①常温下,铝遇冷的浓硫酸、浓硝酸产生钝化现象,即:浓硫酸、浓硝酸将铝的表面氧化成一层致密的氧化物薄膜,这层莫阻止了酸与内层金属的进一步反应。但在加热的条件下铝可以和浓硫酸、浓硝酸反应
②铝与浓硝酸共热:

注意:常温下,能用铝制容器盛放浓硫酸、浓硝酸的原因是二者能使铝发生“钝化”,而不是铝与浓硫酸、浓硝酸不反应
4、Al与碱溶液的反应
铝与氢氧化钠溶液反应 | |
实验操作 |
|
实验现象 | 铝片逐渐溶解,有无色气泡冒出,将点燃的木条放在试管口有爆鸣声 |
化学方程式 | 2Al+2H2O+2NaOH===2NaAlO2+3H2↑ |
离子方程式 | 2Al+2OH-+2H2O===2AlO2+3H2↑ |
注意:
①铝与氢氧化钠溶液反反应的机理:铝先与强碱溶液中的水反应生成H2和Al(OH)3,Al(OH)3可溶于NaOH生成NaAlO2和H2O,反应中Al为还原剂,水为氧化剂
反应过程:
2Al+6H2O===2Al(OH)3↓+3H2↑
(属于氧化还原反应)
2Al(OH)3+2NaOH===2NaAlO2+4H2O
(非氧化还原反应)
双线桥法 |
|
单线桥法 |
|
②能与铝反应产生氢气的溶液可能呈强酸性也可能呈强碱性
③活泼金属与酸反应是金属的通性,而铝不但能与酸(H+)反应,还能够与碱溶液反应,表现出特殊性:

5、Al与盐溶液反应:
2Al+3CuSO4===Al2(SO4)3+3Cu
2Al+3Cu2+==2Al3++3Cu
6、Al与Fe2O3、MnO2、Cr2O3等金属氧化物发生铝热反应


(四)铝的酸、碱反应的规律分析
1、等质量的铝与足量的盐酸、氢氧化钠溶液分别反应:
(1)生成H2的物质的量之比为1∶1。
(2)消耗H+、OH-的物质的量之比为n(H+)∶n(OH-)=3∶1。
2、足量的铝分别与等物质的量的HCl和NaOH反应:
(1)生成H2的物质的量之比为1∶3。
(2)消耗Al的物质的量之比为1∶3。
3、一定量的铝分别与一定量的盐酸、氢氧化钠溶液反应:
若产生氢气的体积比为
 ,
,
则必定
(1)铝与盐酸反应时,铝过量而HCl不足。
(2)铝与氢氧化钠溶液反应时,铝不足而NaOH过量。
(五)铝热反应实验中的有关问题
(1)概念:
某些金属氧化物粉末,与铝粉混合后在较高温度下剧烈反应生成Al2O3和其它金属并放出大量的热的反应,叫铝热反应
(2)原理:
铝作还原剂,另一种氧化物作氧化剂,用铝将氧化物中的金属置换出来
(3)铝热剂:
铝粉和某些金属氧化物(Fe2O3、V2O5、Cr2O3、MnO2等)组成的混合
(4)反应特点:
在高温下进行,反应迅速并放出大量的热,新生成的金属单质呈液态易Al2O3分离
(5)实验过程:
实验步骤 | ①取一张圆形滤纸,倒入5克炒干的氧化铁(Fe2O3)粉末,再倒入2克铝粉、将两者混合均匀 ②用两张圆形滤纸,分别折叠成漏斗状,将其中一个取出,在底部撕一个孔,用水润湿下面一点,再跟 另一个漏斗套在一起,使四周都有4层 ③将折好的滤纸架在铁圈上,下面放置盛沙的蒸发皿,把混合均匀的氧化铁粉末和铝粉倒入纸漏斗中 ④再在上面加少量氯酸钾,并在混合物中间插一根镁条 ⑤点燃镁条,观察发生的现象 |
实验装置 |
|
实验现象 | ①镁带剧烈燃烧,放出大量的热,并发出耀眼的白光,氧化铁与铝粉在较高温度下发生剧烈的反应 ②纸漏斗的下部被烧穿,有熔融物落入沙中 |
实验结论 | 高温下,铝与氧化铁发生反应,放出大量的热
|
原理应用 | ①制取熔点较高、活动性弱于Al的金属,如铁、铬、锰、钨等
②金属焊接,如:野外焊接钢轨等
|
操作要点 | ①内层纸漏斗底部剪个小孔:使熔融物易于落下 ②蒸发皿盛沙:防止高温熔融物溅落炸裂蒸发皿 ③镁条:制造高温条件,引起氯酸钾分解,引发铝热反应 ④氯酸钾:制造氧气利于反应 |
【微点拨】 | ①Al与MgO不能发生铝热反应 ②铝热反应不是一个反应,而是一类反应 ③铝热反应为放热反应 |
(六)铝的制备及用途
1、制备(电解熔融Al2O3):

(冰晶石的作用是作为熔剂,降低氧化铝的熔点)
2、用途:
①纯铝用作导线 ②铝合金制备汽车、飞机、生活用品等
二、氧化铝(Al2O3)
1、物理性质:白色固体,难溶于水,熔点很高,是优良耐火材料
2、化学性质:Al2O3是典性的两性氧化物,既能与酸,又能与碱反应
(1)能与酸反应:

(2)能与碱反应:
![]()
两性氧化物:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,称为两性氧化物
(3)电分解反应
①阳极反应:
![]()
②阴极反应:
![]()
③电解反应:
![]()
④冰晶石的作用:形成低熔点共熔物
⑤阳极石墨与氧气反应,被消耗,需要定期更换

3、Al2O3的制备
(1)实验室制法:
![]()
(2)工业制法:铝土矿→Al2O3
4、主要用途
(1)耐火材料:制耐火坩埚、耐火管和耐高温的实验仪器
(2)炼铝原料:电解熔融的氧化铝
三、氢氧化铝[Al(OH)3]
1、物理性质:
白色胶状不溶于水的固体,有较强的吸附性
2、化学性质:
Al(OH)3是典型的两性氢氧化物,既能与酸,又能与碱反应
(1)能与酸反应:
![]()
(2)能与碱反应:
![]()
两性氢氧化物:既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,称为两性氢氧化物
Al(OH)3的电离方式 |
|
与酸和碱反应过程 | Al(OH)3电离强度相当微弱,只有加入强酸(或强碱)时,大量H+(或OH-)才能破坏Al(OH)3的电离平衡,使平衡向右(或左)移动,生成铝盐(或偏铝酸盐),所以Al(OH)3既具有碱性,又具有酸性,当加入弱酸或弱碱时,因H+或OH-浓度太小,不能使上述平衡移动,因此Al(OH)3只溶于强酸或强碱,而不溶于弱酸(H2CO3等)、弱碱(NH3·H2O) |
注意 | 强酸或强碱也是相对而言的,Al(OH)3不溶于H2CO3、NH3·H2O,但溶于CH3COOH |
(3)热稳定性差:
![]()
3、用途
(1)Al(OH)3有较强的吸附性,能凝聚水中悬浮物,又能吸附色素,可以用作净水剂
(2)Al(OH)3碱性不强,不至于对胃壁产生强烈的刺激作用或腐蚀作用,却可以与酸反应,起到中和胃酸的作用,可以用作胃酸中和剂
4、实验室制备Al(OH)3的三种方法
(1)可溶性铝盐溶液与过量氨水反应
![]()
(2)向可溶性偏铝酸盐溶液中通入过量CO2
![]()
(3)相互促进水解法

5、有关Al(OH)3的少量、过量问题
(1)NaOH和AlCl3

(2)NaAlO2和HCl

(3)NaAlO2和CO2

四、铝盐
1.Al3+和烧碱溶液反应
(1)少量烧碱:
![]()
(2)过量烧碱:
![]()
(3)滴加顺序不同,现象不同
①向铝盐溶液中滴加强碱溶液:
![]()

②向强碱溶液中滴加铝盐溶液:
![]()

2.Al3+和过量氨水反应
(1)离子反应:
![]()
(2)反应现象:产生白色沉淀
(3)应用:实验制取Al(OH)3沉淀
3.水解性:

(4)双水解

五、明矾——十二水合硫酸铝钾
1、化学式:
KAl(SO4)2·12H2O (十二水合硫酸铝钾)
2、电离方程式:

3、属类:
复盐(由两种不同的金属离子和一种酸根离子组成的化合物)
4、物理性质:
无色晶体,可溶于水
5、用途:
作净水剂,原因是其在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来
6、化学性质:
兼有Al3+和SO42-性质
六、偏铝酸盐
1.相当处理:
![]()
2.和盐酸反应
(1)少量盐酸:
![]()
(2)过量盐酸:
![]()
(3)滴加顺序不同,现象不同
①向偏铝酸盐溶液中滴加强酸溶液:
![]()

②向强酸溶液中滴加偏铝酸盐溶液:
![]()

3.和CO2反应
(1)少量CO2:
![]()
(2)过量CO2:
![]()
4.和NaHCO3溶液反应:
![]()
5.水解性

6.铝土矿提铝(Al2O3,含少量Fe2O3和SiO2)
(1)强酸→强碱→弱酸法

(2)强碱→强酸→弱碱法

七、互滴实验
(试剂的滴加顺序不同而产生的现象不同)
1、NaOH和AlCl3
(1)向AlCl3溶液中逐滴加入NaOH溶液(开始时NaOH不足)

现象:先产生白色沉淀后沉淀消失
(2)向NaOH溶液中逐滴加入AlCl3溶液(开始时NaOH过量)
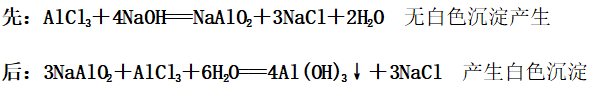
现象:开始无现象后出现白色沉淀
2、NaAlO2和盐酸
(1)向NaAlO2溶液中逐滴加入盐酸

现象:先产生白色沉淀后沉淀消失
(2)向盐酸中逐滴加入NaAlO2溶液

现象:开始无现象后出现白色沉淀
3、Na2CO3溶液与盐酸
(1)向Na2CO3溶液中逐滴加入盐酸(开始时酸不足)

现象:刚开始无气泡产生,盐酸滴加到一定量后,有气泡产生
(2)向盐酸中逐滴加入Na2CO3溶液(开始时酸过量)
![]()
现象:立即产生大量的气泡
八、“铝三角”的转化关系及其应用
1、Al3+、Al(OH)3、AlO2-之间的转化关系

2、“铝三角”转化的应用
(1)选择制备Al(OH)3的最佳途径
①向铝盐中加入足量氨水,离子方程式为:
![]()
②向偏铝酸盐中通入足量CO2,离子方程式为:
![]()
③NaAlO2与AlCl3的溶液混合,离子方程式为:
![]()
(2)分析离子反应顺序
当溶液中有多种离子存在时,要考虑离子之间的反应顺序,如向含有H+、NH4+、Mg2+、Al3+的溶液中逐滴加入NaOH溶液时,NaOH先与H+反应,然后与Al3+、Mg2+反应生成沉淀,再与NH4+反应,最后溶解Al(OH)3沉淀。

- 全部评论(0)











