硅和硅的化合物释疑四十例(问题集)
时间:2023-11-29 11:01 来源:未知 作者:化学自习室 点击:次 所属专题: 硅及其化合物
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
1、实验室盛放碱液的试剂瓶要用橡胶塞而不能用玻璃塞,原因是玻璃成份中的SiO2要和NaOH反应生成Na2SiO3,将玻璃瓶口和玻璃塞粘住 ,可为什么试剂瓶壁却不与NaOH溶液反应呢?
答:事实证明:NaOH和玻璃中SiO2的反应速率、程度与NaOH的浓度、反应的温度及仪器表面的光滑度有关。盛放NaOH溶液的试剂瓶口的内壁和瓶塞经磨砂处理后,表面变得粗糙,形成无数的突起和棱角,这既增加了反应的活性,又造成了溶液的滞留,而且由于水份的逐渐蒸发会使NaOH溶液的浓度增大,常温下碱溶液长时间与玻璃塞附近的玻璃接触就发生了反应生成Na2SiO3,使瓶口与瓶塞粘在一起,而光滑度很好的玻璃与碱液接触,即使加热也极难反应,较长 时间加热盛NaOH溶液按计划管不见任何现象,就可以证明这一点。但如果把NaOH固体和SiO2混合加热,则反应容易进行,我们可以用一个实验来证实:在一个小试管中放入少量固体NaOH,夹持在铁架台上加热NaOH熔融(熔点318.4℃)后,再加热较短时间,冷却,可观察到试管底失去透明现象,这是由于玻璃受到了熔融NaOH的腐蚀。如果加热较长时间,熔融NaOH则会穿透试管底。
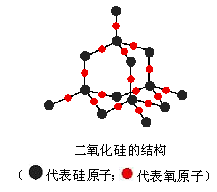
2、二氧化硅是立体网状的晶体,其中最小的封闭环上有几个原子?
答:通过观察金刚石的结构模型和课本金刚石的结构示意图,我们可以得出:在金属刚石的晶体中,有许多共价键形成的碳原子环,其中最小的环上有6个碳原子,硅的结构类似于金刚石,如果在硅的晶体结构中每个Si—Si中间嵌入一个氧原子,就可以得到SiO2的结构模型。通过它很容易得出,SiO2晶体中最小的封存闭环上有6个氧原子、6个硅原子,共12个原子。
3、为什么“SiO2”不是二氧化硅的分子式?
答:二氧化硅晶体中,每个Si原子和4个O原子结合形成4个共价键,每个硅原子周围有4个O原子,同时每个O跟2个Si结合,即每个硅原子位于正四面体的中心,四个氧位于4个顶角,而每个O被两个正四面体共用。所以SiO2晶体是由Si和O按1∶2的比例所组成的立体网状结构的晶体,因此可用“SiO2”来表示二氧化硅的组成,因在晶体中不存在二氧化硅分子,所以“SiO2”不是分子式,只能称其为化学式。
4、二氧化碳与硅酸钠溶液反应可以生成硅酸,另外生成的是Na2CO3还是NaHCO3?
答: H2CO3是二元酸,其电离常数K1=4.30×10-7, K2=5.61×10-11, H2SiO3是更弱的二元酯,其电离常数K3=2. 0×10-10, K4=1.0×10-12,两者相比得K1 >K3> K2 >K4。所以酸性强弱的次序是:H2CO3>H2SiO3>HCO3->HSiO3-
因此CO2与Na2SiO3溶液反应时,一般情况下是生成NaHCO3,但当CO2的量不足或很少时,也会生成Na2CO3。
5、硅酸和常见含氧酸相比有什么特点?
答:硅酸和常见报含氧酸相经,特点主要有:
(1)组成复杂。硅酸为组成复杂的白色固体,常随形成条件的不同而有不同的组成,主要有:硅酸(H2SiO3)、原硅酸(H4SiO4)、二硅酸(H6Si2O7)、三硅酸(H4Si3O8)等。在各种硅酸中常以硅酸的组成最简单,所以常用H2SiO3这一化学式代表硅酸。
(2)制法不同。SiO2为硅酸的酸酐,由于SiO2不溶于水,所以不能用SiO2与水直接反应得到硅酸,而只能用可溶性硅酸盐与酸反应制取。
(3)难溶弱酸。在常见含氧酸中,只有硅酸难溶于水,且酸性极弱,它不能使指示剂变色。
(4)极易缩合。一般来说,含氧酸的酸越弱,缩合性越强(H2CO3除外)。在常见的含氧酸中,原硅酸(H4SiO4)缩合性最强,它经过脱水可得到一系列酸,包括硅酸和多硅酸。
(5)易成凝胶。在可溶性硅酸盐中加入酸,开始生成单分子硅酸,当单分子硅酸逐渐缩合为多酸时,就形成硅酸溶胶。在此溶液中加入电解质,或者在适当浓的Na2SiO3溶液中加入酸则得到半凝固状态、软而透明、且有弹性的硅酸凝胶。将硅酸凝胶用热水充分洗涤除去可溶性的盐类,在60~70℃烘干,并徐徐升温至300℃脱水适当脱水而不除尽即得包含有无数微小孔隙表面积很大的一种物质——硅胶。如果将硅酸凝胶用CoCl2溶液润泡,干燥脱水即得变色硅胶。
6、为什么常用氧化物的形式来表示硅酸盐的组成?
答:硅酸盐的种类繁多,组成结构复杂。其阴离子的基本结构单元为SiO4四面体。除了可以由单个的硅氧四面体和阳离子形成硅酸盐外,还可由多个SiO4四面体通过顶角上的1个或2个或3个、4个氧原子连接发形成环状、链状、片状或三向空间网络结构,金属阳离子则分布于环、链、片或网的空隙之中。因此硅酸盐既可以看作是金属的硅氧化合物,也可以看作是酸性氧化物和碱性氧化物组成的复杂化合物,而用通式aMxOy·bSiO2·cH2O来表示。虽然我们可以用一般化学式来表示硅酸盐的组成,但不如用元素氧化物形式表示显得更清楚、更直观。需要注意的是:通式aMxOy·bSiO2·cH2O中a 、b、c不能是分数;除氧外,有几种元素就写几种氧化物。如果金属氧化物多于一种时,按K、Na、Ca、Mg、Al的顺序排列;氧化物的形式要与盐的组成相符。
7、1mol SiO2中含有Si—O键物质的量是多少?
答:可用下列方法进行计算:
(1)用价电子计算:每个硅原子拿出4个价电子,每个氧原子拿出2个价电子,1mol 二氧化硅共有价电子4+2×2=8mol。而每形成1mol 共价键需电子2mol,所以1mol 二氧化硅中含共价键是4mol。
(2)从基本结构单元得出:
SiO2晶体中的基本结构单元是硅氧四面体[SiO4]。在硅氧四面体中,Si原子位于四面体的中心,4个O原子分别位于四面体的4个顶点,形成4个Si-O键。每一个硅氧四面体以共用顶点O原子的方式和相邻的4个硅氧四面体连接,由此形成SiO2晶体。在SiO2晶体的一个基本结构单元中, 一个Si原子和周围的氧原子形成4个Si-O键完全属于该单元,所以,1mol SiO2晶体中含有4mol Si-O键。
8、多数非金属形成的含氧酸包括正盐和酸式盐,为什么硅酸盐却很少出现酸式盐?
答:硅酸盐实际是H2SiO3、H4SiO4和由它们缩水结合而成的各种酸所对应盐的统称。组成结构复杂,其阴离子的基本结构单元为硅氧四面体[SiO4]。除了可以由单个的硅氧四面体[SiO4]和阳离子形成硅酸盐外,还可由多个硅氧四面体[SiO4]通过顶角上的1个或2个或3个、4个氧原子连接发形成环状、链状、片状或三向空间网络结构,金属阳离子则分布于环、链、片或网的空隙之中。因此很少有酸式盐出现。
9、Na2SiO3的水溶液为什么称作泡花碱,又称水玻璃?
答:Na2SiO3是强碱弱酸盐,在水溶液中可发生水解生成二硅酸盐或多硅酸盐:
Na2SiO3+2H2O= NaH3SiO4+NaOH
2NaH3SiO4= Na2H4Si2O7+H2O
由于水解使溶液呈碱性,所以Na2SiO3的水溶液称作泡花碱。
其实Na2SiO3溶液是由多种硅酸盐组成的混合物,其化学组成可表示为Na2O·nSiO3,而普通玻璃是以Na2CO3 、CaCO3和SiO2为原料制成的,其主要成分为Na2O·CaO·6SiO2,成分相似,所以Na2SiO3溶液又可以称作水玻璃。
10、硅酸的酸性弱于碳酸,但却能发生如下反应:
Na2CO3+SiO2 Na2SiO3+CO2↑为什么?
Na2SiO3+CO2↑为什么?
答: 二氧化碳通入Na2SiO3溶液中可发生如下反应:
Na2SiO3+CO2+H2O = H2SiO3↓+ Na2CO3
符合强酸制备弱酸的反应规律,但此规律只适用于水溶液中,而在非水的条件下不一定适用,在高温下发生
Na2CO3+SiO2 Na2SiO3+CO2↑的原因是由于H2SiO3为难挥发性酸,H2CO3易分解生成挥发性物质,符合干态条件下高沸点物质制低沸点物质的反应规律。类似的规律还有实验室用浓硫酸制HCl、HNO3
Na2SiO3+CO2↑的原因是由于H2SiO3为难挥发性酸,H2CO3易分解生成挥发性物质,符合干态条件下高沸点物质制低沸点物质的反应规律。类似的规律还有实验室用浓硫酸制HCl、HNO3
NaCl+H2SO4(浓) NaHSO4+HCl↑
NaHSO4+HCl↑
NaNO3+H2SO4(浓) NaHSO4+HNO3↑
NaHSO4+HNO3↑
上述两反应并不是由于硫酸的强酸性,而是利用了硫酸为高沸点酸来制低沸点的酸HCl、HNO3。
11、SiO2既能与氢氟酸反应,又能与NaOH溶液反应,所以SiO2是两性化合物对吗?
答:不对。SiO2是酸性氧化物,尽管SiO2能与氢氟酸反应得到盐“SiF4”和水,但是SiO2不能和其他酸反应,却能和Ca(OH)2、NaOH等溶液反应生成盐和水,所以SiO2只是酸性氧化物。
12、非金属氧化物的熔沸点很低,为什么SiO2的熔沸点却很高?
答:非金属氧化物一般为分子晶体,而SiO2为原子晶体,分子晶体中分子以分子间作用力结合,而分子间作用力很弱,破坏它使晶体变为液体和气体比较容易,而在SiO2晶体中每个硅原子以sp3杂化轨道与四个氧原子以σ键结合,形成硅氧四面体,在每个硅氧四面体结构单元中,Si—O键键能很高,同时硅氧四面体结构单元通过共用顶角氧连成立体网状结构,所以要使它熔化必须消耗更多的能量,因此SiO2的熔沸点却很高
13、硅酸、原硅酸、硅胶有什么不同?
答:硅酸的化学式为H2SiO3,原硅酸的化学式为H4SiO4。硅酸和原硅酸均难溶于水,均为二元弱酸,其酸比碳酸还弱,其酸酐均为SiO2,硅酸比原硅酸稳定。易成凝胶。在可溶性硅酸盐(Na2SiO3)中加入酸(如HCl)反应生成原硅酸沉淀,原硅酸在空气中干燥失去一部分水可得到硅酸:
Na2SiO3+2HCl+ H2O = H2SiO3↓+ Na2CO3
H4SiO4= H2SiO3+H2O
硅酸的全称是:硅酸凝胶或氧化硅胶,化学式为m SiO2·n H2O将硅酸凝胶用热水充分洗涤除去可溶性的盐类,在60~70℃烘干,并徐徐升温至300℃适当脱水而不除尽即得包含有无数微小孔隙、表面积很大的一种物质——硅胶。它是一种白色稍透明的固态物质,具有高度的多孔性,其表面积很大,每克硅胶的内表面可大至8000—9000m2,硅胶有很强的吸附能力,可作吸附剂,在实验室中常用作干燥剂。如果在制硅胶时,加入CoCl2,可制得变色硅胶。无水Co2+呈兰色,水合Co2+呈粉红色。随着吸附的水分子的增多,硅胶的颜色由兰色变到粉红色,吸了水的硅胶加热脱水后,可以恢复兰色和吸湿能力。
硅胶是很好的干燥剂、吸附剂以及催化剂的载体。
14、水泥的标号是怎样测定的?
答:水泥的标号是水泥强度大小的标志。用标准砂一包加水泥450克,加225毫升水,搅拌成型,制成边长为7.07cm的立方体试块,按标准条件20±2℃、相对湿度为90%以上的条件下养护至28天时,用抗折机和抗压机检验其抗折强度和抗压强度。例如检测得到28D后的抗压强度为310 kg/cm2,则水泥的标号定为300号。抗压强度为300-400 kg/cm2者均算为300号。普通水泥有:200、250、300、400、500、600六种标号。200号-300号的可用于一些房屋建筑。400号以上的可用于建筑较大的桥梁或厂房,以及一些重要路面和制造预制构件。
15、光导纤维的工作原理是什么?
答:光导纤维是一种透明的用二氧化硅做成的能高质量传导光的玻璃纤维丝,直径只有100μm(左右)。光导纤维结构呈圆柱形,一般由两层组成,里面一层称为内芯,直径几十微米,折射率较高,外面一层称为包层,折射率较低。光由纤维的一端进入,经内芯反复折射而传到末端,由于两层折射率的差别,使进入内芯的光始终保持在内芯中传输着。其原理和下面的情形相似:如果您希望手电筒的光束照亮又长又直的走廊,那么只需将光束顺着走廊方向照去即可,光线是沿直线传播的,这没什么问题;那么如果走廊不是直的呢?您可以在拐弯处放一面镜子,在拐角周围反射光束;那么如果走廊有很多拐弯呢?您可能需要沿墙放置许多面镜子来反射光束,使其沿着走廊不断反射。这就是光纤的工作原理。光缆中的光在纤芯(走廊)中通过不断反射到覆层(装满镜子的墙)来进行传播,这就是全内反射的原理。由于覆层并不会从纤芯中吸收任何光,因此光波能够传播很远的距离。
信号在传播时,首先来自谈话者的声音信号在一只普通的话筒中被转变为电信号,然后将电信号通过一个发射机被转变为光信号,使光的强度随电信号的幅度(频率)变化而变化并通过光纤发送出去,在线路的另一端,光信号接受机将光信号转换为电信号经解调后恢复原信息。
在实际使用时,常将千百根光导纤维组合在一起并加以增强处理,制成像电缆一样的光缆,这样既提高了光导纤维的强度,在大大增强了通信容量,
16、碱性氧化物一般可与酸反应,SiO2是酸性氧化物不是碱性氧化物却能与HF反应 SiO2+4HF=SiF4↑+2H2O,为什么?
答:有以下几个原因:常温下生成物四氟化硅是气态的(沸点- 95.7℃),四氟化硅容易脱离反应体系,使反应平衡右移;硅氧键的键能为422.5kJ/mol,硅氟键键能为565 kJ/mol,显然硅氟键的键能比硅氧键的键能大,所以有不稳定的键能低的共价键形成更稳定的键能高的共价键的趋势;产物四氟化硅容易形成络离子:SiF4+2F -==SiF6 2-,形成的(SiF6)2-是十分稳定的配离子。
17、从元素周期表的位置看,碳和硅均为ⅣA元素,碳比硅稍活泼,在自然界有游离态存在的金刚石和石墨,为什么没有游态的硅,只有化合态存在的硅?
答:Si—O的键长为166pm,Si—Si键长235 pm,Si—O的键能为452kJ/mol,Si—Si的键能为226kJ/mol,从键能和键长来看,Si—O的稳定性比Si—Si强。在地壳形成时温度很高,且硅与氧有很高亲合能力,能够生成更为稳定的Si—O四面体结构,因此丰度仅次于氧的硅单质在自然界中就不存在了,即自然界中不存在由Si—Si键连接的纯硅单质,而基本上是以更为稳定的Si—O键结合的二氧化硅和硅酸盐的形式存在。
18.工业上如何制取硅单质?
答:工业上制取硅单质分三步:
(1)用焦炭在电炉中将石英砂还原制得粗硅
SiO2+2C Si+2CO↑
Si+2CO↑
(2)粗硅与氯气有加热条件下反应生成SiCl4或粗硅与干燥HCl气体反应制得SiHCl3:
Si(粗)+2Cl2 SiCl4
SiCl4
Si+3HCl SiHCl3+H2
SiHCl3+H2
硅的卤化物是共价化合物,熔、沸点很低,如SiCl4的沸点为330.8K因此可用精馏方法将SiCl4 、SiHCl3提纯后用H2还原。
(3)用H2还原SiCl4或SiHCl3
SiCl4+2H2 Si(纯)+4HCl
Si(纯)+4HCl
SiHCl3+H2 Si(纯)+3HCl
Si(纯)+3HCl
19、SiO2和C 在高温条件下反应为什么生成的产物是Si和CO而不是Si和CO2?
答:很多教师认为SiO2和C 在高温条件下反应首先生成Si和CO2,高温条件下CO2和C反应又生成CO。通过ΔrG=ΔH-TΔS计算可知,反应SiO2+2C Si+2CO↑要进行所需的的最低温度为1767K,而反应 SiO2+C
Si+2CO↑要进行所需的的最低温度为1767K,而反应 SiO2+C Si+CO2↑要进行所需的最低温度为2521K,两者相差754K,所以在工业上二氧化硅和碳反应写成SiO2+2C
Si+CO2↑要进行所需的最低温度为2521K,两者相差754K,所以在工业上二氧化硅和碳反应写成SiO2+2C Si+2CO↑更合理。
Si+2CO↑更合理。
20、能否用硅和H2制备SiH4?
答:Si不能与H2直接作用生成硅烷,简单的硅烷常用金属硅化物与酸反应来制取,例如:Mg2Si+4HCl= SiH4↑+2 MgCl2
或者用强还原剂LiAlH4还原硅的卤化物
2 Si2Cl6(l)+3LiAlH4(s)=2Si2H6(g)+3LiCl(s)+3AlCl3(s)
SiH4和Si2H6是无色无臭的气体。
21、为什么SiH4比CH4活泼?
答:(1)SiH4还原性比CH4强。SiH4能与氧气或其它氧化剂猛烈反应,在空气中能自燃,燃烧时放出大量的热,产物为SiO2。这是由于硅在元素周期表中位于碳的下部,其原子半径大于碳的原子半径,非金属性较碳弱。
(2)SiH4的热稳定性差。将其加热到500℃即分解为单质硅和氢气。这是由于硅和碳位于同一主族,非金属性硅比碳弱,且Si—Si键能(222kJ/mol)和Si—H键的键能(318kJ/mol)比C—C键的键能(345.6 kJ/mol)和C—H键的键能(411±7 kJ/mol)小,故SiH4的稳定性比CH4差。
(3)SiH4比CH4易水解。
其原因是硅原子半径比碳大(硅原子半径0.117nm,碳原子半径0.077nm),可极化度大,而电负性较小,与C、H相连时呈正电性,因此易受亲核试剂进攻。由于硅原子体积较大,在反应时所受空间位阻较小,因而化学反应活性比碳大。另外硅原子除以sp3杂化轨道成键外,还可利用其空的3d轨道参与成键,采取sp3d杂化(五配位体,双三角锥型络合物)或sp3d2杂化(六配位体,正八面体型络合物)形成不同的化合物。故SiH4比CH4易水解。
22、为什么H2SiO3、Na2SiO3等具有黏性?
答:在硅酸和高浓度的硅酸钠溶液中并不存在单独的H2SiO3分子或SiO32-独立结构单元,而实际上是通过分子间的脱水形成的一个个以“SiO4”四面体为单元的长链形结构。长链形结构绕曲后又可以形成“空洞”结构,“空洞”中存在的是离子和溶剂,它的移动会导致周围众多阳离子的和溶剂一起走,这就是其黏性的产生原因。所以硅酸和硅酸钠都具有一定的黏性。
23、为什么不能用玻璃瓶盛放氢氟酸和氟化铵溶液?
答;玻璃中含有大量SiO2,会发生如下反应SiO2+4HF=SiF4↑+2H2O玻璃瓶受到腐蚀,因此可用于雕刻玻璃。氟化铵溶液由于水解F-+H2O HF+OH-生成HF也不能用玻璃瓶盛放
HF+OH-生成HF也不能用玻璃瓶盛放
24、石英玻璃与钢化玻璃的成分有什么不同?
答:不相同。石英玻璃的主要成分是SiO2,石英熔融后粘度很大,不易结晶,急速冷却,形成了石英玻璃,它是SiO2的无定形体。石英玻璃能耐高温,烧至1400℃也不发软,石英玻璃膨胀系数很小,即使把它烧到白热,随即投入冷水中也不致破裂。由于石英玻璃这些优良性能,常用于制造高温时使用的仪器和高级化学仪器。石英玻璃能透过紫外线,用于制造光学仪器。
而钢化玻璃的成分与普通玻璃成分相同(Na2SiO3、CaSiO3 和SiO2 的混合物)。钢化玻璃是将普通退火玻璃先切割成要求尺寸,然后加热到接近软化点的700度左右,再进行快速均匀的冷却而得到的。普通玻璃的抗震性较差,且损坏后残渣呈尖锐的角,易伤人。而钢化玻璃一是强度较之普通玻璃提高数倍,抗弯。钢化玻璃的耐急冷急热性质较之普通玻璃有3~5倍的提高,一般可承受250度以上的温差变化,对防止热炸裂有明显的效果;第二是使用安全,其承载能力增大改善了易碎性质,即使钢化玻璃破坏也呈无锐角的小碎片,对人体的伤害极大地降低了,是安全玻璃中的一种。为保障高层建筑提供合格材料安全性作保障。
25、为什么碳和氧可以形成小分子CO2,硅却不能?
答;CO2在常温下是气体,SiO2常温下是固体。因为碳的原子半径比硅的小,在C和O之间可以形成C=O双键(1个σ键和1个P—Pπ键),而硅不能形成P—Pπ键,而倾向于形成较多的σ单键再形成聚合体,例如通过Si—O—Si链形形色色的SiO2和硅酸盐。通过比较键能的大小,也知Si=O(键能:640.2kJ/mol)不及C=O(键能:798.9kJ/mol)稳定,所以硅不能象碳那样以Si=O双键形成有限分子。
26、有SiO吗?
答:有。固态SiO可在1300℃真空条件下用Si还原SiO2得到,SiO为黄褐色无定形固体,密度2.13g/cm3,熔点约1702℃,沸点1880℃,不稳定,在空气中能氧化成SiO2,也易歧化成Si和SiO2。可用于电子工业和制造光学玻璃。
27、人教版化学1P71实验4—1的操作是:在试管中加入2mL 饱和Na2SiO3溶液,滴入1~2滴酚酞溶液,再用胶头滴管逐滴加入稀盐酸,边加边振荡,至溶液颜色变浅并接近消失时停止。发生的现象是:当滴入酚酞时,溶液颜色由无色变成红色。滴入盐酸时,溶液颜色由红色逐渐变浅,此时得到的是澄清透明液体,没有不溶物析出,但静置一段时间后,倾斜试管,发现试管中的液体凝固无色透明的胶冻状物质,不能流出。这是什么原因呢?
答:当稀盐酸慢慢滴加到硅酸钠溶液中并不断振荡试管时,开始生成的的少量单分子硅酸能溶于水,当这些单分子硅酸逐渐缩合为多酸时,生成了硅酸的胶体溶液——硅酸溶胶;当胶体溶液浓度足够大且静置时,硅酸分子很快通过分子间的脱水发生缩聚反应,形成了一系列多聚硅酸的链状分子:



这些多聚硅酸的链状分子在运动过程中彼此相比缠绕,交织了很多“结”,同时也构与了很多“空洞”,水分子被固定在它些“空洞”时,从而使分散系变成了白色胶冻状的、软而透明的半固体物质——硅酸凝胶(在多酸骨架里包含有大量的水)
28、二氧化硅晶体有哪些规律和特点?
答:由下图可以看出:

(1)一个硅原子和2个氧原子之间的夹角∠O—Si—O=109°28′
(2)最小原子环上的原子数为12
在二氧化硅晶体结构中,Si原子的排列方式和金刚石晶体中碳原子的排列方式是相同的,在金刚石晶体中,每个最小环上有6个碳原子,因此SiO2晶体中每个最小环上有6个Si原子,另外六边形每条边上都夹入了一个氧原子,所以最小原子环上的原子数为12,其中有6个Si原子和6个O原子,含有12个Si-O键。
(3)最小的十二元环并非在一个平面上,而是呈“椅式”结构。
(4)每个Si—O键同时被6个环所共用。
(5)每个Si原子被12个最小环共有,每个O原子被6个十二元环共有。
由图可以看出,每个硅原子周围有四条边,而每条边又被6个环共有,同时由于每个环上有两条边是同一个硅原子周围的,因此还要除以2以剔除重复,所以最终计算式为(4×6)/2=12或每个硅原子均被2C42=12个十二元环共用,每个氧被2C31=6个十二元环共用。
(6)每个最小环平均拥有1个氧原子
由于每个硅原子子被12个环共有,因此每个环只占有该硅原子的1/12,又因为每个环上最小环上有6个硅原子,所以每个最小环上平均拥有的硅原子数为: 6×(1/12)=0.5。又因为SiO2晶体是由硅原子和氧原子按1:2的比例所组成,因此氧原子的数目为0.5×2=1
(7)晶体中Si、O原子最外层都满足8电子稳定结构
晶体中,每个Si原子形成四个共价键后借入4个电子而实现了8电子稳定结构,每个氧原子形成2个共价键后借入2个电子而实现了8电子稳定结构,
(8)晶体中硅原子与Si—O键数之比n(Si): n(Si—O)=1:4
(9)SiO2的晶胞中“SiO2”数目为8
从SiO2的晶胞中可以看出,有8个硅原子位于立方晶胞的8个顶角上,有6个硅原子位于晶胞的6个面心上,还有4个硅原子与16个氧原子在晶胞内构成4个硅氧四面体[SiO4],均匀错开排列于晶胞内。
SiO2的晶胞内含有的硅原子数为:8×(1/8)+6×(1/2)+4=8,氧原子数为16,即每个SiO2晶胞内含有8个“SiO2”。
(10)求晶胞立方体的边长(设为a)
该晶胞的体积为a3,若二氧化硅晶体的密度为ρ g/cm3,则应有:
a3:8= 1cm3:ρ g·NA /(60g·mol-1)


(11)求晶胞中Si—O键键长(设Si—O键长为r)
从图中取出一正方形ABCF,连结AD、BD,如右图,

再从图中找出ΔAED,∠AED =109°28′
AE和DE的长度可近似为2r,则由余弦定律得
AD2=AE2+DE2-2AE·DE·cos109°28′

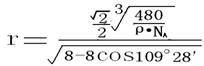
29、硅晶体的结构特点和规律有哪些?
答:(1)硅晶体中,每个硅原子都以sp3杂化轨道与四个硅原子形成共价单键,构成正四面体。每个硅原子位于正四面体的中心,周围四个硅原子位于四个顶点上,在空间延展,构成立体网状结构。因此,可以把整个晶体看成为一个巨大的分子。
(2)硅晶体中,Si原子个数与Si—Si键数之比:每个Si原子和另外的4个Si原子形成4个σ键,而对每个键的贡献只有一半,故Si原子个数与Si—Si键个数之比为1:(4×1/2)=1:2;
(3)硅晶体中最小的原子环:由六个Si原子组成且6个Si原子且不在一个平面上。而是椅式“ ”六元Si环。
”六元Si环。
(4)每条Si—Si键均被2C31=6个硅环共用,故只有六分之一归属每个六硅环,每个六硅环各占6×1/6=1个Si—Si键。
(5)每个Si原子均被2C42=12个六硅环共用,故只有十二分之一归属每个六硅环,故每个六硅环各占6×1/12=1/2个硅原子。
(6)28克硅晶体即1mol SiO2中含Si—Si键数:2NA
(7)硅晶体和金刚石一样都属于面心立方晶胞。硅晶体的晶胞实际上是由8个相邻的小立方体并置堆砌而成,黑色的硅位于相互错开排列的4个小立方体的中心,其余硅原子位于大立方体的8个顶点和6个面上。该晶胞实际分摊到的硅原子数一共是8+6+4=18个但是,顶点和面心的Si原子实际上是与其它晶胞共用的,所以在实际计算时需要进行折算,定点是1/8,面心是1/2
所以,晶胞中实际含有的含Si原子数是=4+6×1/2+8×1/8=8个
(8)硅晶体中Si—Si的键长为2.35×10-10m
把整个硅晶胞分成四个体积相等的小正方体,每个小正方体的体对角线是两倍键长则晶胞的体对角线4倍Si—Si的键长
设Si—Si的键长为r,晶胞的边长为a
则应有:
a3:8= 1cm3:ρ g·NA/(28g·mol-1)


如右图连结AB、AC和BC,取出一直角三角形形ΔABC,
由勾股定理不难证明晶胞的体对角线

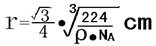
二氧化硅晶体的密度为2.32g/cm3,
则可计算出Si—Si的键长

30、怎样证明SiO2是酸性氧化物?
答:SiO2不溶于水,也不能与水反应,但能与强碱发生反应只生成盐和水,
SiO2+2NaOH=Na2SiO3+H2O
由此证明SiO2是酸性氧化物。
31、什么是硅藻土?
答:(1)形成:硅藻土一般是由统称为硅藻的单细胞藻类死亡以后的硅酸盐遗骸经过1至2万年左右的堆积期,形成的一种化石性的硅藻堆积土矿床。
(2)成分:主要是SiO2,通常占80%以上,最高可达94%。还含有少量的Al2O3、Fe2O3、CaO、MgO、K2O、Na2O、P2O5和有机质。其中SiO2中硅氧四面体呈杂乱的堆积是无定型的SiO2。
(3)颜色:白色、灰白色、灰色和浅灰褐色等,
(4)特性:具有多孔结构、密度低、较大的比表面积、吸附能力强、悬浮性能好,物化性能稳定,隔音隔热、耐磨、耐酸、无毒和无味等特殊性能。
(5)应用:广泛用于轻工、化工、建材、石油、医药、卫生等部门
32、硅为什么能导电?单晶硅太阳能电池发电的基本原理是什么?
答:非金属一般为非导体,不导电,但硅的晶体却是良好的半导体材料。利用能带理论可以解释其导电性:在半导体晶体中,其能量较高的导带是空的,能量较低的价电子能带是满带,电子只有在导带上才能导电。如果电子得到能量就会从价电子带越过禁带(价电子能带和导带之间的能量间隔)跃迁到导带就能导电了。
在硅晶体中,价电子能带和导带之间的禁带比较狭窄(绝缘体的能带间隙Eg≥5EV,半导体的Eg≤3EV),电子受到光电注入或热激发后,价带中的部分电子会越过禁带进入能量较高的空带,空带中存在电子后成为导带,价带中缺少一个电子后形成一个带正电的空位,称为空穴,导带中的电子和价带中的空穴合称为电子 - 空穴对。上述产生的电子和空穴均能自由移动,电子可在其间自由流动,两个能带都成为导带,加热或光照会使半导体发生热激发或光激发,从而产生更多的电子 - 空穴对,使其导电性增加,因为温度愈高,电子愈容易被激发越过禁带。
没有掺杂且无晶格缺陷的纯净半导体在常温下电导率较小,而且电子 - 空穴对浓度对温度变化敏感,所以很难对半导体特性进行控制,因此实际应用不多。
在纯硅中掺入杂质,将极大地影响其导电性。如果掺入少量ⅢA元素如B,则晶体中比成键所要求的价电子少一个电子,留下了一个带正电荷的“空穴”,价电子能带中的价电子很容易激发到“空穴”的能级中去,所以导电性增加。这类掺杂半导休称为P型半导体;如果掺入少量ⅤA元素如P,由于这些掺杂原子在硅中成键只需4个电子,因而多了一个电子,这个额外的电子在晶体中流动,使晶体导电性增加。这类掺杂半导休称为N型半导体;掺杂实际上作用是缩小了禁带的宽度即价电子能带与导带之间的能量间隙由于电子的释放和“空穴”的产生而减小了。例硅的Eg=1.1eV,在硅中掺入P原子后,激发一个电子至导带的能量约为0.044eV,掺铝后,激发一个“空穴”至价电子能带的能量只有0.057eV。
当P型和N型半导体结合在一起时,在两种半导体的交界面区域里会形成一个特殊的薄层,界面的P型一侧带负电,N型一侧带正电。这是由于P型半导体多空穴,N型半导体多自由电子),出现了浓度差。N区的电子会扩散到P区,P区的空穴会扩散到N区,一旦扩散就形成了一个有N指向P的“内电场”,又称势垒电场,从而阻止扩散进行。达到平衡后,就形成了这样一个特殊的薄层形成电势差,从而形成P—N结。由于此处电阻特别高,所以也称为阻挡层。当太阳光照射P—N结时,在半导体内的电子由于获得了光能而释放电子,相应地便产生了电子——空穴对,并在势垒电场的作用下,电子被驱向N型区,空穴被驱向P型区,从而使N型区有过剩的电子,P型区有过剩的空穴,于是就在P—N结的附近形成了与势垒电场方向相反的光生电场,光生电场的一部分抵消势垒电场,其余部分使P型区带正电,N型区带负电;于是,就使得在N型区与P型区之间的薄层产生了电动势,即光生伏打电动势。接通电路时便有电能输出,这就是P—N结接触型单晶硅太阳能电池发电的基本原理。
33、硅的还原性大于碳,这和碳能在高温下还原出硅有矛盾吗?
答:两者并不矛盾。碳和硅位于元素周期表中的Ⅳa族,由元素周期表的知识可得,碳的原子半径小于硅,失电子能力比硅弱,所以硅的还原性比碳强,那为什么碳又能把二氧化硅中的硅置换出来昵?这是由于碳的沸点比硅高,且高温下生成了气态物质CO,有利于反应向生成物的方向进行,故发生了这一反应、:
2C
+SiO2 Si+CO2↑
Si+CO2↑
34、硅与NaOH溶液可生成如下反应:Si+2NaOH+2H2O ==Na2SiO3+2H2↑氧化剂是NaOH和H2O吗?
答:硅与NaOH溶液反应分两步:
Si+4H2O= H2SiO3+2H2↑
H2SiO3+2NaOH= Na2SiO3+2H2O
从分步反应来看,H2O是氧化剂, NaOH既不是氧化剂也不是还原剂,但NaOH能使不溶于水的H2SiO3转变为易溶于水的Na2SiO3,从而促进硅与水的反应,
发生反应时电子转移的方向和数目表示如下:

35、硅在常温下能与氢氟酸反应吗?
答:实验:将纯度较高的硅片置于盛有氢氟酸的塑料杯内,观察不出有任何反应的迹象,甚至将硅片长时间浸泡在氢氟酸内,也毫无变化。如果在HF酸中加几滴HNO3,则发生反应。
结论:常温下,硅是不能跟氢氟酸发生化学反应的。只是二氧化硅才能跟氢氟酸作用。
原因:常温下单质硅不溶于氢氟酸。若有氧化剂(硝酸、三氧化铬、高锰酸钾、过氧化氢等)存在的条件下与HF酸能发生反应:
Si (s)+4HF(aq) SiF4(g)+2H2(g) ΔG°=-327.9kJ/mol
SiF4(g)+2H2(g) ΔG°=-327.9kJ/mol
为了溶解硅,可使用浓硝酸和氢氟酸的混合物。氢氟酸是弱酸,不具备强氧化性,不可能氧化单质硅;硝酸虽有强氧化性,但生成的正4价硅在溶液中没有合适配体与之形成稳定化合物. 当使用硝酸和氢氟酸混合物时,硝酸使硅表面单质硅氧化为二氧化硅,之后氢氟酸又将硝酸氧化产生的这层氧化膜溶解掉,两种酸如此交替作用就可以达到溶解单质的目的。因为氢氟酸提供的氟离子是正4价硅的良好配体。所以硝酸是氧化剂,氢氟酸是配合剂。
化学反应方程式:3Si + 4HNO3 + 18HF = 3H2SiF6 + 4NO + 8H2O ΔG°=-2133kJ/mol
36、硅及其化合物有哪些特殊性?
答:硅及其化合物特殊性有:
(1)、一般非金属单质为绝缘体石墨为导体,硅为良好的半导体,常用于电子部件
(2)、在所有的非金属元素中,只有硅及其最高价氧化物二氧化硅的晶体是原子晶体。
(3)、非金属单质与强碱反应一般不生成氢气,而硅可与强碱溶液反应产生氢气
Si+2NaOH+H2O==Na2SiO3+2H2↑
(4)、非金属单质一般不与非氧化性酸反应,而硅却能与氢氟酸反应,且能置换出氢气。
Si+4HF2==SiF4↑+2 H2↑
(5)、酸性氧化物一般能直接跟水化合生成酸,但二氧化硅却不能跟水化合制得硅酸,硅 酸只能用相应的可溶性硅酸盐与酸作用制得。
(6)、酸性氧化物一般不与酸反应(尤其是非氧化性酸)反应,而二氧化硅却能与氢氟酸反应。
SiO2+4HF=SiF4↑+2H2O
(7)、在碳族元素的氧化物中,只有二氧化硅属于原子晶体。
(8)、绝大多数非金属元素的最高价含氧酸只有一种,而硅的+4价含氧酸有许多种。如硅酸(H2SiO3)、原硅酸(H4SiO4)、二硅酸(H6Si2O7)、三硅酸(H4Si3O8)
(9)、无机酸一般易溶于水,而硅酸和原硅酸等却难溶于水。
(10)、碳化硅、二氧化硅、金刚石等原子晶体一般不导电,而晶体硅却是半导体。
(11)、一般既能与酸反应,又能与碱反应的氧化物是两性氧化物,但SiO2却是酸性氧化物
(12)、较强酸制较弱酸是复分解反应的一个规律,H2CO3酸性强于 H2SiO3但下列两个反应也可顺利进行:
Na2CO3+SiO2 Na2SiO3+CO2↑
Na2SiO3+CO2↑
CaCO3+SiO2 CaSiO3+CO2↑
CaSiO3+CO2↑
(13)、通常所说的某酸盐为一种酸所对应的盐,而硅酸盐是指明硅酸、原硅酸和由它们缩水结合而成的各种酸所对应的盐。
(14)、在碳族元素的氢化物中,只有SiH4在空气中能自燃
SiH4+2O2=SiO2+2H2O
(15)、由硅酸制得的硅胶具有很强的吸附作用,常用作干燥剂和吸附剂。
(16)、硅藻土含有无定形二氧化硅,它的表面积很大,吸附能力较强,可用作吸附剂和催化剂的载体,以及保温材料等。
(17)、四氟化硅的水解产物与其它卤化硅不同,如SiCl4+3H2O = H2SiO3↓4HCl而SiF4水解后生成的HF还可以继续同SiF4反应生成H2SiF6:
3SiF4+3H2O = H2SiO3↓+H2SiF6
37、碳和硅为什么容易形成共价化合物?
答;碳和硅都是位于在元素周期表中ⅣA族的非金属元素,第ⅣA族元素位于周期表里容易失去电子的主族元素和容易得到电子的主族元素的中间位置,其原子核外最外层都有4个电子,既不容易得到4个电子形成离子,也不容易失去4个电子形成离子,所以它们容易生成共价化合物。
38、变压器的铁芯为什么要用硅钢片?
用做变压器的铁芯,一般选用0.35mm厚的冷轧硅钢片,按所需铁芯的尺寸,将它裁成长形片,然后彼此绝缘并交叠成“日”字形或“口”字形。
硅钢是一种合硅的钢,其含硅量在0.8~4.8%。由硅钢做变压器的铁芯,是因为硅钢本身是一种导磁能力很强的磁性物质,在通电线圈中,它可以产生较大的磁感应强度,从而可以使变压器的体积缩小。
我们知道,实际的变压器总是在交流状态下工作,功率损耗不仅在线圈的电阻上,也产生在交变电流磁化下的铁芯中。通常把铁芯中的功率损耗叫“铁损”,铁损由两个原因造成,一个是“磁滞损耗”,一个是“涡流损耗”。
磁滞损耗是铁芯在磁化过程中,由于存在磁滞现象而产生的铁损,这种损耗的大小与材料的磁滞回线所包围的面积大小成正比。硅钢的磁滞回线狭小,用它做变压器的铁芯磁滞损耗较小,可使其发热程度大大减小。
只所以把硅钢做成片状铁芯还可以减小另外一种铁损──“涡流损耗”。变压器工作时,线圈中有交变电流,它产生的磁通当然是交变的。这个变化的磁通在铁芯中产生感应电流。铁芯中产生的感应电流,在垂直于磁通方向的平面内环流着,所以叫涡流。涡流损耗同样使铁芯发热。为了减小涡流损耗,变压器的铁芯用彼此绝缘的硅钢片叠成,使涡流在狭长形的回路中,通过较小的截面,以增大涡流通路上的电阻;同时,硅钢中的硅使材料的电阻率增大,也起到减小涡流的作用。
39、为什么碳的氢化物种类有成千上万种,而硅的氢化物只有十几种?
答:碳的化合物种类繁多的原因是由于:
(1)碳原子含有4个价电子,可以跟其它原子形成4个共价键;
(2)碳原子之间可以形成稳定的单键、双键、叁键且双键、叁键的位置可以不同
(3)多个碳原子可以相互结合成长短不一的碳链,碳链也可带有支链;
(4)多个碳原子还可以相互结合成环,碳环和碳链 还可以相互结合;
(5)有机物分子普遍存在同分异构现象。
而硅的成键有以下特点:
(1)Si-Si键(键能221.5 kJ/mol)没有C-C键(键能327.3 kJ/mol)牢固,因此硅原子不能形成很长的硅链。所以生成的氢化物要少得多,到目前为止,已制得的硅烷也不到12个,其中熟悉的有: SiH4、Si2H6、Si3H8、Si4H10、Si5H12和Si6H14六种直链的或支链的氢化硅。硅烷的通式SinH2n+2。(1≤n≤7)
(2)、硅一般不能形成烯烃、炔烃相应的硅化物,也不形成简单的硅芳香环。
40、什么是有机硅化合物?
答:有机硅化合物简称有机硅,是分子中含有碳-硅键的有机化合物。与有机碳化合物相像,有硅烷、卤代硅烷、硅醇和硅醚等。但与有机碳化合物也有不同的地方,有机硅分子中硅-硅原子间只有单键,没有双键和叁键。这类化合物有其特殊的性能,如耐温特性(有机硅不但可耐高温,而且也耐低温,可在一个很宽的温度范围内使用,无论是化学性能还是物理性能,随温度的变化很小)、耐候性(有机硅中自然环境下的使用寿命可达几十年)、良好的电气绝缘性能(是一种稳定的电绝缘材料,既耐热又有优异的拒水性)、优良生理惰性(聚硅氧烷类化合物是已知的最无活性的化合物中的一种。它们十分耐生物老化,与动物体无排异反应,并具有较好的抗凝血性能)、低表面张力和低表面能(有机硅的主链十分柔顺,其分子间的作用力比碳氢化合物要弱得多)
由于有机硅具有上述这些优异的性能,因此它的应用范围非常广泛。它不仅作为航空、尖端技术、军事技术部门的特种材料使用,而且也用于国民经济各部门,其应用范围已扩到:建筑、电子电气、纺织、汽车、机械、皮革造纸、化工轻工、金属和油漆、医药医疗等。

- 全部评论(0)
