化学平衡移动时,v正与v逆的变化情况
时间:2006-12-29 10:00 来源: 作者:黄贞帧 点击:次 所属专题: 平衡移动
版权申明:凡是署名为“化学自习室”,意味着未能联系到原作者,请原作者看到后与我联系(邮箱:79248376@qq.com)!
以mA(气)+nB(气) ![]() pC(气)+ qD(气)+ Q为例说明。原平衡时的反应速率为v正、v逆,外界条件改变后的正、逆反应速率为v'正、v'逆。
pC(气)+ qD(气)+ Q为例说明。原平衡时的反应速率为v正、v逆,外界条件改变后的正、逆反应速率为v'正、v'逆。
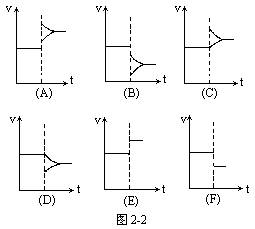
(1)增大物质的浓度:增大反应物浓度时v正、v逆都增大,但v正突然增大,v逆随后逐渐增大,且v正增大的幅度比v逆大,从而v'正>v'逆,平衡向正反应方向移动。增大生成物浓度时,v正、v逆都增大,但v逆增大的多,从而使v'正<v'逆,平衡逆向移动(图2-2中的C)。
(2)减小物质的浓度:减小反应物浓度时,v正、v逆都减小,但v正减小的多,从而使v'正<v'逆,平衡逆向移动。减小生成物浓度时,v正、v逆都减小,但v逆减小的多,从而使v'正>v'逆,平衡正向移动(图2-2中的D)。
(3)增大压强(减小密闭容器的体积)当m+n=p+q时,v正、v逆都增大,且增大的倍数相同,从而使v'正=v'逆,平衡不移动(图2-2中的E)。
当m+n>p+q时,v正、v逆都增大,但v正增大的多,从而使v'正>v'逆,平衡正向移动(图2-2中的A)。
当m+n<p+q时,v正、v逆都增大,但v逆增大的多,从而使v'正<v'逆,平衡逆向移动(图2-2中的A)。
(4)减小压强(扩大密闭容器的体积):当m+n=P+q时,v正、v逆都减小,且减小的倍数相同,从而使v'正=v'逆,平衡不移动(图2-2中的F)。
当m+n>p+q时,v正、v逆都减小,但v正减小的多,从而使v'正<v'逆,平衡逆向移动(图2-2中的B)。
当m+n<p+q时,v正、v逆都减小,但v逆减小的多,从而使v'正>v'逆,平衡正向移动(图2-2中的B)。
(5)升高温度:当Q>0时,正反应是放热反应,升温后v正、v逆都增大,且v逆增大的多,从而使v'正<v'逆,平衡逆向移动(图2-2中的A)。
当Q<0时,正反应是吸热反应,升温后v正、v逆都增大,但v正增大的多,从而使v'正>v'逆,平衡正向移动(图2-2中的A)。
(6)降低温度:当Q>0时,正反应是放热反应,降温后v正、v逆都减小,但v逆减小的多,从而使v'正>v'逆,平衡正向移动(图2-2中的B)。
当Q<0时,正反应是吸热反应,降温后v正、v逆都减小,但v正减小的多,从而使v'正<v'逆,平衡逆向移动(图2-2中的B)。

- 全部评论(0)
